Первый в мире препарат, использующий технологию редактирования генов CRISPR, получил одобрение.
Препарат Exa-cel, также известный под торговой маркой Casgevy, получил свое первое разрешение от Агентства по регулированию лекарственных средств и товаров медицинского назначения Великобритании (MHRA) 16 ноября 2023 года для лечения двух изнурительных заболеваний крови: серповидно-клеточной болезни и трансфузионно-зависимой бета-талассемии. Позже Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило препарат в качестве средства лечения обоих заболеваний.
Историческое решение регуляторов одобрить препарат Casgevy может означать начало новой эры генной терапии. Однако остаются вопросы, связанные с доступностью и долгосрочной безопасностью этого метода лечения.
Что лечит первая одобренная CRISPR-терапия?
MHRA одобрило Casgevy для лечения серповидно-клеточной болезни (СКБ) и трансфузионно-зависимой бета-талассемии. Это пожизненные генетические заболевания, вызванные мутациями в генах, кодирующих гемоглобин — белок, который необходим красным кровяным тельцам для переноса кислорода по организму.
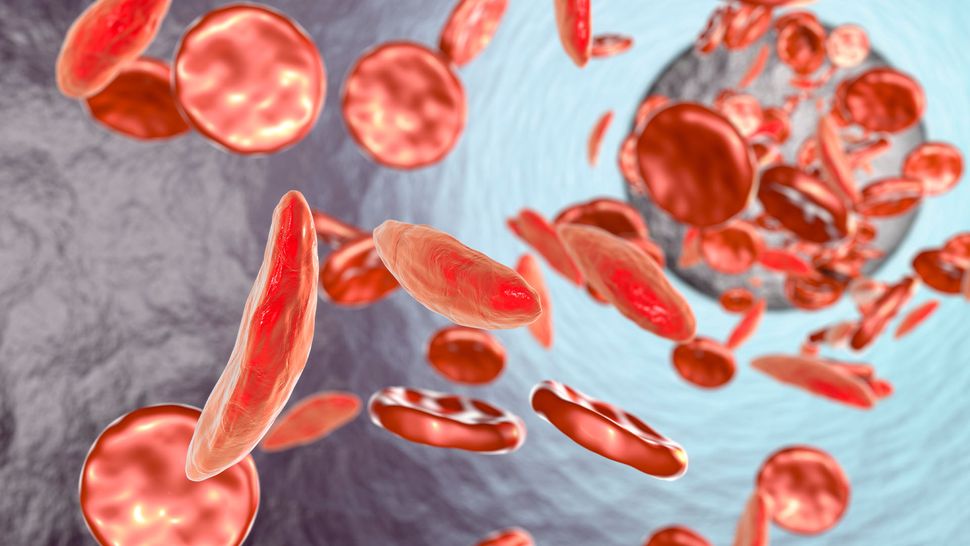
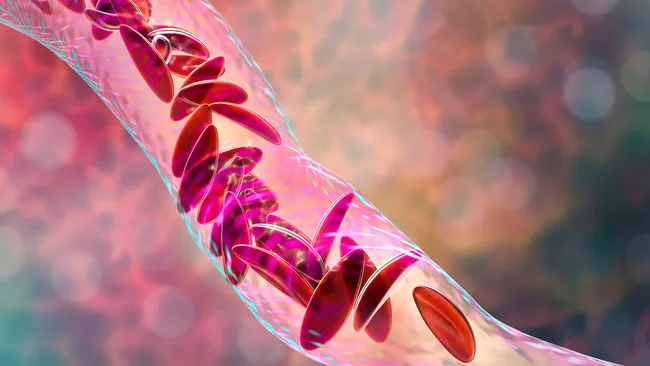
По оценкам, в США более 100 000 человек страдают СКД, но в некоторых группах населения этот показатель выше, чем в других. Например, один из каждых 365 чернокожих детей рождается с СКД. При этом заболевании форма красных кровяных телец человека изменяется таким образом, что они становятся не круглыми, а С-образными. Серповидные клетки быстро погибают, а также прилипают друг к другу, блокируя кровеносные сосуды. В результате у пациентов развивается анемия и часто возникают приступы сильной боли, называемые болевыми кризами.
Бета-талассемией страдает примерно 1 из 100 000 человек во всем мире, и в большей степени от нее страдают люди средиземноморского, азиатского, африканского и ближневосточного происхождения. У пациентов с бета-талассемией не вырабатывается достаточное количество гемоглобина, что может привести к тяжелой анемии, в то время как серповидно-клеточная анемия возникает из-за недостатка здоровых эритроцитов. «Трансфузионно-зависимая» означает, что болезнь настолько тяжела, что пациенты должны регулярно переливать эритроциты на протяжении всей жизни.
Как работает Casgevy?
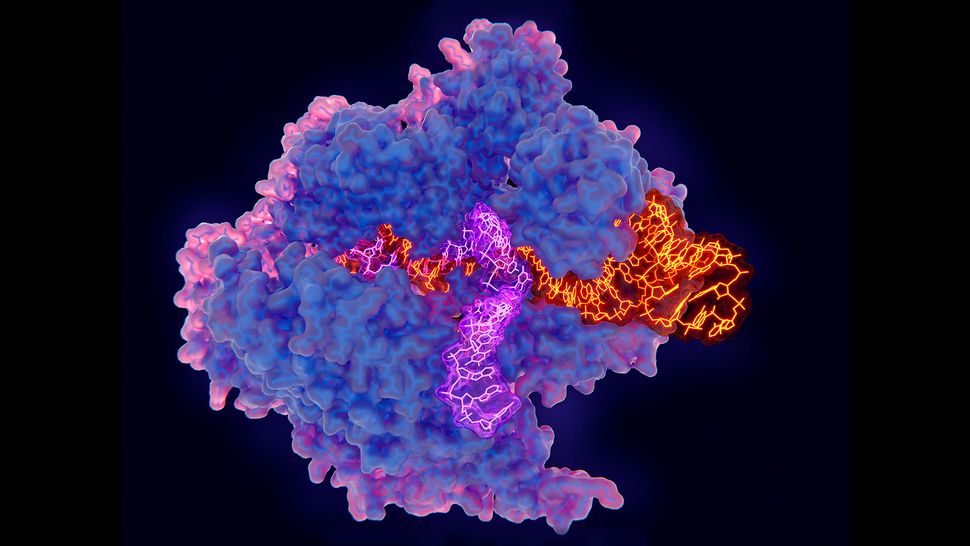
В основе Casgevy лежит революционная технология редактирования генов под названием CRISPR, которая была впервые разработана в 2012 году.
Система CRISPR вырезает гены из ДНК с помощью фермента Cas9. Эти «молекулярные ножницы» направляются к целевой ДНК молекулой РНК. Технология была адаптирована из естественного защитного механизма, который бактерии и другие простые организмы, называемые археями, используют против вирусов.
Касгеви нацелился на ген под названием BCL11A. Этот ген кодирует белок, который в норме регулирует переход от фетальной версии гемоглобина к взрослой вскоре после рождения. Однако у пациентов с СКД и бета-талассемией взрослый гемоглобин дефектен.
Задача Касгеви — отключить BCL11A и тем самым позволить организму продолжать производить фетальный гемоглобин, поскольку взрослая версия не работает. Для этого из костного мозга пациента берутся стволовые клетки, производящие кровь, и в лабораторных условиях с помощью Casgevy редактируется ген BCL11A. Затем модифицированные клетки с функционирующим гемоглобином вводятся в организм пациента. Перед инфузией пациент должен принять химиотерапевтический препарат бусульфан, чтобы уничтожить нередактированные клетки, оставшиеся в костном мозге, сообщает STAT News.
Процесс адаптации к новым, отредактированным клеткам длительный. «Пациентам может потребоваться провести в больнице не менее месяца, пока обработанные клетки приживутся в костном мозге и начнут производить красные кровяные тельца со стабильной формой гемоглобина», — говорится в заявлении MHRA.
В ходе двух клинических испытаний, проведенных на поздних стадиях, Casgevy восстановил выработку гемоглобина у большинства пациентов с СКД и бета-талассемией и облегчил их симптомы. Двадцать восемь из 29 пациентов с СКД не испытывали сильных болевых кризов по крайней мере в течение года после лечения препаратом Casgevy. Аналогичным образом, 39 из 42 пациентов с бета-талассемией не нуждались в переливании эритроцитов в течение того же периода после лечения. Оставшиеся три пациента более чем на 70 % реже нуждались в переливании крови.
Безопасен ли Casgevy?
Ни в одном из двух клинических испытаний Casgevy на поздних стадиях не было отмечено серьезных проблем с безопасностью, хотя сообщалось о некоторых преходящих побочных эффектах, таких как лихорадка и усталость. Оба испытания продолжаются, и долгосрочная безопасность Casgevy продолжает контролироваться регулирующими органами, такими как MHRA и FDA, а также производителями терапии, Vertex Pharmaceuticals и CRISPR Therapeutics.
Однако до сих пор существуют некоторые опасения относительно безопасности терапии на основе CRISPR в целом. В частности, опасения вызывают «нецелевые» эффекты, когда Cas9 воздействует на другие участки генома, не предназначенные для изменения, и вызывает нежелательные побочные эффекты.
«Хорошо известно, что CRISPR может привести к ложным генетическим модификациям с неизвестными последствиями для обработанных клеток», — сказал Дэвид Руэда, заведующий кафедрой молекулярной и клеточной биофизики в Имперском колледже Лондона. «Прежде чем делать выводы, необходимо ознакомиться с данными секвенирования всего генома этих клеток, — сказал он. Для этого необходимо исследовать всю ДНК в клетках, отредактированных Касгеви, чтобы выяснить, есть ли какие-либо внецелевые эффекты».
Где был одобрен препарат Casgevy?
В ноябре 2023 года Великобритания одобрила Casgevy для людей старше 12 лет с серповидно-клеточной болезнью или трансфузионно-зависимой бета-талассемией. В декабре FDA одобрило препарат для людей в возрасте 12 лет и старше с серповидно-клеточной болезнью, а в январе 2024 года агентство одобрило Casgevy для людей с трансфузионно-зависимой бета-талассемией, относящихся к той же возрастной категории.
По данным Vertex, в настоящее время препарат находится на рассмотрении Европейского агентства по лекарственным средствам и Управления по контролю за продуктами и лекарствами Саудовской Аравии, поэтому в скором времени Casgevy может быть одобрен и другими странами.
Когда Casgevy будет доступен для пациентов?
Пока неясно, когда Casgevy станет доступным, но его распространение во многом зависит от стоимости. Генная терапия может стоить миллионы долларов, и, похоже, Casgevy не станет исключением. Это может сделать ее недоступной для многих людей, которые в ней нуждаются.
«Проблема в том, что эти методы лечения будут очень дорогими, поэтому ключевое значение имеет способ сделать их более доступными во всем мире», — сказал Кей Дэвис, профессор анатомии из Оксфордского университета, в интервью британскому научному медиацентру.
Представитель компании Vertex сообщил Nature, что компания еще не установила цену на Casgevy в Великобритании, но «работает с органами здравоохранения, чтобы как можно скорее обеспечить возмещение расходов и доступ к препарату для пациентов, имеющих на него право».
Какие еще CRISPR-лекарства находятся в разработке?
Компания Intellia Therapeutics разрабатывает CRISPR-терапию для лечения наследственных заболеваний изнутри организма, сообщает STAT News.
Кроме того, усовершенствованная версия CRISPR под названием «редактирование оснований», которая может воздействовать на отдельные строительные блоки ДНК, проходит испытания в качестве способа лечения заболеваний. Например, компания Verve Therapeutics тестирует такой экспериментальный метод лечения болезней сердца. Другой многообещающий новый тип терапии, называемый «редактированием прайма», включает CRISPR, но при этом «включает дополнительные ферменты и генетические инструкции для вставки, удаления или переписывания коротких сегментов ДНК», сообщает STAT News.




Нет комментариев