Впервые о бор-нейтронозахватной терапии опухолей заговорили в 1936 году. Бор-нейтронозахватная терапия (БНЗТ) — способ избирательного поражения клеток злокачественных опухолей. В кровь человека вводится специальный борсодержащий раствор, он накапливается в раковых клетках.
Затем опухоль облучают потоком эпитепловых нейтронов, ядра бора поглощают нейтроны, происходят ядерные реакции, в результате чего больные клетки погибают. Методика БНЗТ проверена на ядерных реакторах, которые использовались в качестве источника нейтронов, но внедрить реактор в повседневную клиническую практику слишком сложно.
Для этих целей больше подходят ускорители заряженных частиц: компактны, безопасны и обеспечивают лучшее качество нейтронного пучка. О феноменальной эффективности БНЗТ говорят не одно десятилетие.
Например, американские физики отрабатывали метод на мышах еще во время Второй мировой войны. Успешные эксперименты проводились в Японии, бор-нейтронозахватная терапия дала многообещающие результаты.
Но понадобилось почти 90 лет, чтобы метод начал входить в клиническую практику. Сегодня БНЗТ подтвердила свою эффективность и начинает применяться не только в Китае, Японии и Южной Корее, но и в России.
Важную роль в продвижении метода сыграл ИЯФ СО РАН. Именно здесь был разработан и построен лучший по характеристикам ускорительный источник нейтронов VITA.
Уникальный источник отрицательных ионов, хорошо работающая в разных режимах ускоряющая система, возможность управления пучком и его диагностики, литиевая мишень, способная служить долго без изменения параметров, — все это сделало машину оптимальной для онкологических центров.
ИЯФ СО РАН собрал источник нейтронов для НМИЦ онкологии им. Н.Н.Блохина Минздрава России (Москва). Сейчас вместе с Новосибирским государственным университетом и медицинскими учреждениями проводит доклинические испытания метода.
Клинические испытания БНЗТ планируется проводить с 2025 года на базе НМИЦ онкологии им. Н.Н.Блохина. В ожидании этого специалисты ИЯФ продолжают модернизировать экспериментальный источник нейтронов для онкотерапии. Недавно физики разработали и внедрили диагностические методы дозиметрии, которые позволяют оценить уровень получаемых от источника полезной борной дозы и сопутствующих — гамма-излучения, быстрых нейтронов и азотной дозы.
— В отличие от других методов лучевой терапии, например, гамма-терапии, где наличествует только гамма-излучение, в БНЗТ принято выделять четыре компоненты дозы облучения: борную, азотную, быстрых нейтронов и гамма-излучения, — пояснил главный научный сотрудник ИЯФ СО РАН доктор физико-математических наук Сергей Таскаев.
— Все эти четыре дозы надо регистрировать, чтобы характеризовать пучок, а затем и оценивать реакцию пациента на лечение. Ранее считалось, что борную и азотную компоненты дозы невозможно измерить в принципе, но мы попытались, и у нас получилось.
Первый существенный прогресс достигнут после разработки малогабаритного детектора нейтронов — над его созданием работало несколько команд нашего института. Детектор измеряет пространственное распределение борной дозы и дозы гамма-излучения в воздухе и водном фантоме с разрешением 1 мм.
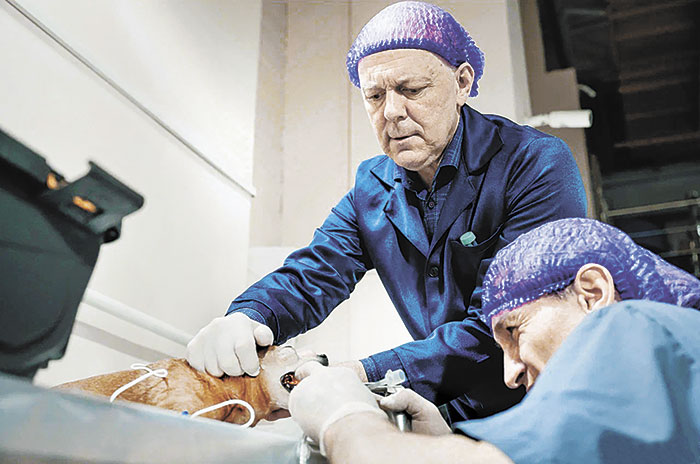
Сейчас мы активно используем детектор в исследовательских целях: располагаем рядом с зоной облучения при проведении экспериментальной терапии кошек и собак, контролируя таким образом характеристики пучка. Планируем, что прибором будет оснащена установка в онкоцентре Блохина.
Но все же к широкому внедрению БНЗТ есть серьезное препятствие — по словам онкологов, в России не производят радиофармпрепарат на основе бора для захвата опухолевой клеткой и последующего разрушения опухоли. Его должны сначала разработать химики, а затем испытать медики.
Конечно, разработка такого препарата — дело ближайшего будущего и требует соединения усилий институтов РАН и университетов. Тем временем в лаборатории ядерной и инновационной медицины ФФ НГУ решили не ограничиваться испытаниями одного метода терапии.
— Параллельно мы испытываем еще один вариант нейтронозахватной терапии, уже без бора, предусматривающий использование реакторов, которые в отличие от ускорителей работают фактически непрерывно, и препаратов на основе гадолиния, — рассказал заведующий лабораторией кандидат медицинских наук Владимир Каныгин.
По словам ученого, реакторов, которые после доработки можно использовать в медицинских учреждениях, у нас заметно больше, чем специально сконструированных ускорителей для БНЗТ, да и с производством препаратов на основе гадолиния проблем нет — они уже достаточно давно и широко применяются в качестве контрастных соединений.
Успешно испытав нейтронозахватную терапию на грызунах, исследователи НГУ в сотрудничестве с коллегами из Томского политехнического университета, где есть специально оборудованный реактор, перешли к лечению более крупных животных — собак и кошек — со спонтанными опухолями, которые затем развиваются в различные виды рака, аналогичные тем, от которых страдает человек.
— Главной проблемой стало изучение динамики состояния четвероногих пациентов после проведения курса НЗТ. До недавнего времени томографы, на которых можно обследовать крупных животных, были в большом дефиците.
У нас в регионе такой есть только в одной ветеринарной клинике, и сеанс томографии — весьма дорогая услуга, поэтому, если с питомцем после лечения все хорошо, хозяева не спешат ею пользоваться.
К сожалению, это сильно замедляло испытания, поскольку их необходимо проводить в строгом соответствии с принятыми протоколами, — добавил Владимир Каныгин.
Однако благодаря программе «Приоритет-2030» вышеупомянутый томограф появился и в НГУ. Новые возможности позволят приблизить следующий этап исследований — клинические испытания.
А пока сибирские университеты совершенствуют необходимый для онкотерапии софт. Недавно ученые ТПУ зарегистрировали первое в России программное обеспечение для планирования нейтронной терапии злокачественных опухолей.
ПО разработано специалистами университета и НИИ онкологии Томского национального исследовательского медицинского центра. Приложение дает возможность медицинским физикам более точно рассчитать значения дозовой нагрузки при планировании гамма-нейтронной терапии злокачественных опухолей на циклотроне У-120, оптимизировать распределение дозы в тканях и органах, а также позволяет радиологам оценить возможные риски и побочные эффекты для пациента.
Ольга Колесова
Фото предоставлено пресс-службой НГУ




Нет комментариев