От этих простых химических соединений зависят структура и свойства вещества. Взаимодействие молекул определяет биологические процессы в живых организмах, возникновение физических сил, переходы между агрегатными состояниями и многое другое. В этой статье мы погрузимся в мир молекул, разберем их строение и свойства, а также узнаем, как изучение этих крошечных частиц способствует развитию науки и технологий.
Что такое молекула?
Молекула — это группа из двух или более атомов, которые удерживаются вместе благодаря химическим связям. Название термина произошло от латинского слова «moles», что в переводе на русский язык означает «маленькая масса». И хотя именно атомы являются мельчайшими частицами, позволяющими определить тип вещества, от молекул зависит его химическая сущность. Например, атом кислорода встречается в свободном виде крайне редко, так как постоянно участвует в реакциях окисления. При этом молекула кислорода, состоящая из 2 его атомов, является более устойчивой формой, широко распространенной в земной атмосфере.
Отличие молекул от атомов и ионов
В общем смысле молекулы и атомы отличаются друг от друга, как музыкальные ноты и аккорды. Одна нота звучит достаточно просто, однако их комбинации порождают насыщенные и гармоничные звучания. Похожую ситуацию мы наблюдаем с молекулами — атомы хлора и натрия по отдельности не проявляют свойств соли, однако, соединяясь вместе, они образуют хлорид натрия с соленым вкусом. При этом понятия «молекулы» и «атомы» в некоторых случаях могут быть тождественны. Например, благородные или инертные газы, такие как гелий или аргон, обладают крайне низкой реактивностью и поэтому состоят всего из одного атома. Но в кинетической теории газов эти одноатомные элементы считаются молекулами.
В обычном состоянии атом имеет нейтральный электрический заряд из-за одинакового количества положительно и отрицательно заряженных протонов и электронов в его структуре. Однако в силу разных причин этот баланс может быть нарушен, и тогда атом становится ионом: катионом (+) или анионом (-). Если такие атомы входят в состав молекул, образуются заряженные молекулярные ионы. Распространенным примером молекулярных ионов являются нитраты, содержащие анион NO3-. Дисбаланс объясняется разной степенью окисления атомов азота и кислорода, что влияет на порядок перемещения электронов и, как следствие, электрический заряд.
Строение молекул
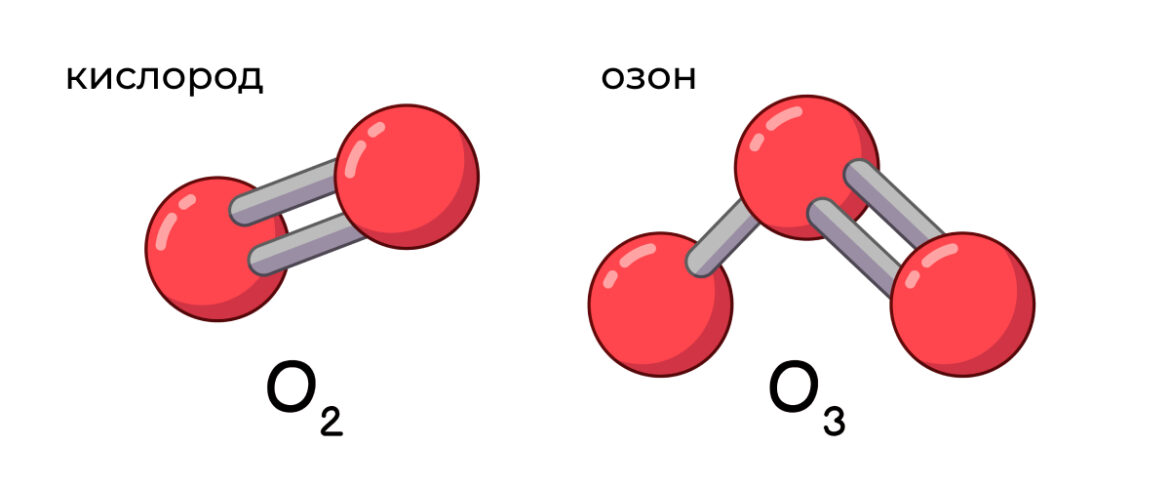
Строение молекул определяется химическими связями между атомами. От характера этих взаимодействий зависят почти все свойства того или иного вещества. Например, кислород и озон (O2 и O3) состоят из одних и тех же атомов кислорода. Но при этом кислород не имеет запаха и необходим живым существам для дыхания, тогда как озон обладает и резким запахом, и высокой токсичностью. Существует два основных типа химических связей, определяющих строение молекул.
- Ковалентные связи
Валентность показывает потенциальную возможность атома принимать или отдавать электроны в результате взаимодействия. Совместно используемые электроны называют электронными парами, а сам процесс обмена — ковалентной связью. Такие элементы, как литий и водород имеют постоянную валентность I и могут образовывать по одной ковалентной связи, как, например, гидрид лития LiH.
Однако валентность может быть не только постоянной, но и переменной, то есть в разных химических соединениях атомы могут устанавливать разное количество связей. Поглощая энергию, некоторые атомы переходят в возбужденные состояния, и их электроны перераспределяются по энергетическим уровням. Для примера разберем переменную валентность фосфора. В соединениях с сильными окислителями он имеет сразу 5 валентных электронов, а с более слабыми — только 3. Таким образом, пентаоксид фосфора имеет формулу P2O5, а его трихлорид — PCl3.
Строение молекул определяется не только ковалентными связями атомов, но и их фактическим расположением относительно друг друга. Возьмем пероксид натрия с формулой Na2O2. Учитывая постоянную валентность натрия и кислорода (I и IIсоответственно), может показаться, что такое соединение нарушает химические законы. Однако молекула имеет структуру Na–O–O–Na, в которой четко прослеживается, что атомы натрия имеют по одной ковалентной связи, а атомы кислорода — по две.
- Ионные связи
Ионная связь атомов основана на принципе электростатического притяжения, при котором противоположно заряженные частицы притягиваются друг к другу. Таким образом, электронные пары между катионами и анионами возникают вследствие электроотрицательности, а не ковалентности. Важно отметить, что при нормальной температуре и давлении в ионных соединениях чаще всего невозможно идентифицировать отдельные молекулы, однако они могут формироваться при переходе вещества в другое агрегатное состояние. Например, твердый хлорид алюминия представляет собой кристаллическую решетку, но при нагреве свыше 180 °C он сублимируется, превращаясь в газ и образуя молекулы Al2Cl6.
Функции молекул
Функции молекул многогранны и всеобъемлющи, так как абсолютное большинство физических и химических процессов происходит при их непосредственном участии. Они зависят от структуры молекул, химических связей между ними и внешних условий. Исходя из этого, можно выделить следующие основные функции молекул:
- химические — образование и разрыв химических связей, участие в реакциях, преобразование веществ;
- биологические — передача генетической информации, обмен веществ, поддержание структуры клеток;
- экологические — круговороты веществ в природе, защита атмосферы от ультрафиолета, разложение отходов жизнедеятельности;
- технологические — разработка молекулярных транзисторов, полимерных материалов, микрочипов и сенсоров.

Молекулы простых и сложных веществ
Если не принимать во внимание одноатомные газы, молекулы простых веществ являются гомоядерными, то есть состоящими из атомов одного и того же химического элемента. Как правило, в их структуру входят от 2 до 4 атомов:
- азот — N2;
- озон — O3;
- фосфор — P4.
Существуют и более экзотичные варианты гомоядерных молекул — аллотропы. Например, при температуре ниже -219 °C молекулы кислорода формируются в кристаллические восьмиатомные структуры, известные как твердый кислород (O8). К необычным аллотропам также можно отнести гексасеру (S8), которая образуется при охлаждении расплавленной серы и часто используется в химической промышленности.
Специфичным типом простых веществ являются металлы, хотя в большинстве случаев они не имеют молекулярной структуры. Вместо этого они образуют кристаллическую решетку, в которой электроны могут свободно перемещаться между ионами. Однако при переходе в газообразное состояние кристаллические решетки распадаются или на отдельные атомы, или на двухатомные соединения, которые условно можно назвать молекулами. Типичным примером такого соединения является газообразный натрий — Na2.
Молекулы сложных веществ — это значительно более широкая группа, ведь в нее входят химические соединения двух и более разных атомов. В химии сложные вещества делятся на 2 основные подгруппы: органические и неорганические.
В состав органических соединений обязательно входят атомы углерода. Молекулы органических веществ являются основой всех живых организмов, в связи с чем некоторые специалисты используют термин «углеродные формы жизни». Например, молекулы глюкозы (C6H12O6) — это наиболее распространенный источник энергии для животных и растений.
В обобщенной классификации к сложным неорганическим веществам, состоящим из молекул, относятся:
- оксиды — соединения химических элементов с кислородом (оксид натрия: NO3);
- основания — металлы с присоединенной группой OH (гидроксид калия: KOH);
- кислоты — молекулы с катионами водорода, которые могут замещаться металлами (соляная кислота: HCl).

Примеры наиболее важных молекул
- Вода (H₂O): структура, свойства, значение для жизни
Молекула воды представляет собой одно из самых распространенных на нашей планете неорганических соединений. В нем 2 атома водорода и 1 атом кислорода, соединенные ковалентной связью, формируют V-образную структуру. Одним из важных физических свойств воды является расширение при замерзании. Оно объясняется тем, что лед имеет кристаллическую структуру, в которой молекулы располагаются дальше друг от друга, чем в жидкой воде.
Вода имеет первостепенное значение для существования жизни по ряду причин:
- это универсальный растворитель, который создает условия для биохимических реакций;
- вода составляет порядка 90% плазмы крови и обеспечивает транспортировку растворенных в ней питательных веществ к разным системам организма;
- благодаря испарению вода способствует терморегуляции как отдельных живых организмов, так и всей биосферы.
- Озон (O3): его роль в атмосфере и поддержании жизни
Озон — это простое вещество, молекула которого состоит из 3 атомов кислорода. По своему строению она напоминает молекулу воды с той лишь разницей, что угол между связями составляет не 105°, а 117°. В естественных условиях озон содержится в стратосфере, на высоте порядка 20 – 40 километров. Под воздействием ультрафиолетового излучения от Солнца молекулы кислорода распадаются на атомы, после чего образуют новые трехатомные соединения. Так у Земли сформировался озоновый слой, не пропускающий более 97% среднечастотного УФ-излучения. Он выполняет функцию атмосферного щита, предотвращая мутации молекул ДНК.

Молекулярные взаимодействия и их значение для свойств веществ
Межмолекулярными взаимодействиями называют силы притяжения и отталкивания, возникающие между молекулами. В отличие от прочных ковалентных связей, эти силы проявляют себя менее значительно и ослабевают по мере отдаления молекул друг от друга. Основным механизмом взаимодействия молекул считаются силы Ван-дер-Ваальса, открытые голландским физиком в 1869 году. Наблюдая за молекулами в жидкостях и газах, Йоханнес Ван-дер-Ваальс обнаружил следующий эффект. При сближении между молекулами возникает сила притяжения, но когда они оказываются слишком близко друг к другу, проявляет себя уже отталкивающая сила.
Хотя сами молекулы являются электрически нейтральными, заряд внутри их структуры может распределяться неравномерно. Из-за этого возникают постоянные или кратковременные дипольные моменты, то есть противоположные части молекулы приобретают положительные и отрицательные заряды. В соответствии с законом Кулона они начинают притягиваться друг к другу. Чем больше масса молекул и чем меньше расстояние между ними, тем более заметно проявляет себя эта сила. Однако молекулы не могут сближаться бесконечно — в какой-то момент электронные оболочки их атомов соприкасаются. В соответствии с принципом квантового взаимодействия электронные оболочки не могут проникать друг в друга, и молекулы начинают отталкиваться. Минимально возможное расстояние между центрами молекул называют их эффективным диаметром.
Существуют и другие, менее выраженные типы молекулярных взаимодействий, такие как водородные и катионные связи. От совокупности возникающих сил зависят многие свойства веществ. Например, соляная кислота состоит из полярных молекул и имеет значительно более высокую температуру кипения, чем метан, состоящий из неполярных молекул (48 против -161,5 °C). Сахара отлично растворяются в воде из-за возникновения водородных связей между гидроксильными группами. Также от межмолекулярных взаимодействий зависит агрегатное состояние вещества, о чем мы поговорим подробнее в следующем разделе.
Молекулы и физика: газы, жидкости, твердые тела
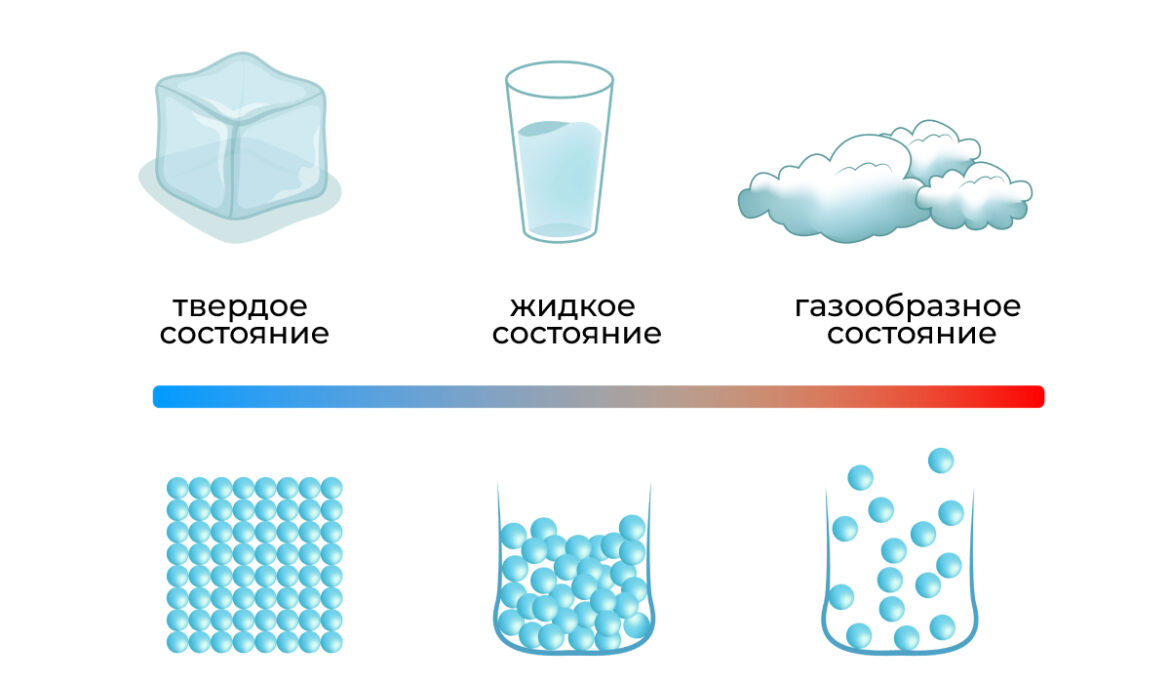
Агрегатное состояние вещества зависит от температуры и давления. При повышении температуры кинетическая энергия молекул увеличивается — из-за высокой скорости их движение становится все более хаотичным, а межмолекулярные взаимодействия ослабевают: твердое вещество начинает превращаться в жидкость, а затем в газ. При низкой температуре кинетическая энергия ослабевает настолько, что над ней начинают преобладать силы притяжения, и газ конденсируется в жидкость. При дальнейшем охлаждении молекулы формируются в строго упорядоченную структуру — кристаллическую решетку, — и возникает твердое тело. Однако движение молекул в твердых веществах не останавливается полностью, они продолжают колебаться вокруг своих фиксированных положений.
Давление также является важным фактором — чем оно ниже, тем более свободно движутся молекулы и тем проще веществам переходить в жидкое или газообразное состояние. Именно поэтому в горах, где атмосферное давление понижено, вода закипает при 70 – 80°C.
Чтобы понять особенности агрегатных состояний вещества, разберем их на простом примере — молекуле воды.
- Твердое состояние. Расстояние между молекулами не меняется и приблизительно соответствует размеру самих молекул. Межмолекулярные связи в кристаллической структуре льда максимально прочны, поэтому он сохраняет свои форму и объем, пока температура остается низкой.
- Жидкое состояние. При нагреве свыше 0 °C и нормальном атмосферном давлении молекулы приходят в беспорядочное движение, но все еще остаются достаточно близко друг к другу. Объем воды при этом остается прежним, однако ее форма может меняться (вода принимает форму сосуда).
- Газообразное состояние. Превысив предел 100 °C или свою точку кипения, вода преобразуется в водяной пар. Из-за высочайшей кинетической энергии молекулы разлетаются в разные стороны, структура вещества нарушается, и его объем может меняться произвольным образом.
Помимо трех основных, существует и четвертое агрегатное состояние вещества — плазма. Для перехода в него необходимы экстремально высокие показатели температуры, при которых нарушаются не только межмолекулярные, но и внутримолекулярные связи. Молекулы распадаются на атомы, а затем начинают терять электроны. Так вещество переходит в состояние ионизированного газа. Молекулы воды начинают распадаться при температуре порядка 3 000 °C, а при дальнейшем нагреве свободные атомы водорода и кислорода высвобождают электроны и образуют плазму.
Молекулы пищи: углеводы, жиры, белки
Вместе с пищей мы получаем огромное количество молекул, которые играют важную роль в процессах жизнедеятельности. Взаимодействуя друг с другом и одновременно с системами нашего организма, они выполняют специфичные и зачастую взаимосвязанные функции. Основными молекулами пищи являются 3 типа макромолекул, то есть сложных молекулярных структур с высокой массой.
- Белки. Представляют собой цепочки аминокислот, соединенных пептидной связью, — полипептидов. Аминокислоты — это органические соединения, включающие карбоксильную группу COOH и аминогруппу CH2. Взаимодействуя, эти группы формируют пептидные, очень прочные ковалентные связи. В организме молекулы белков расщепляются до аминокислот, которые участвуют в обмене веществ, поддерживают целостную структуру клеток и обеспечивают транспортировку других молекул — витаминов и микроэлементов. К высокобелковой пище относятся яйца, мясо курицы и индейки, бобовые и кисломолочные продукты.
- Жиры. Молекулы этого типа, также известные как липиды, объединены в широкую группу органических веществ со сложными эфирными соединениями. Сложные эфиры возникают при реакции карбоновых кислот с трехатомным спиртом (глицерином), в результате чего формируются цепочки, напоминающие по форме трезубец. Главная функция липидов — накопление энергии, которая высвобождается в процессе метаболизма. Также жировые молекулы способствуют терморегуляции организма и защищают клетки от повреждений. В больших количествах жиры содержат свинина, орехи, сливочное и растительные масла.
- Углеводы. Молекулы углеводов обязательно содержат карбонильную группу C=O, то есть атомы углерода и кислорода сразу с двумя общими электронными парами. В структуру этих молекул также входят несколько гидроксильных групп OH, отвечающих за хорошую растворимость в воде и дополнительно усиливающих межмолекулярные связи. Как и жиры, углеводы выполняют энергетическую функцию, однако они расщепляются значительно быстрее. Скорость этого процесса зависит от величины молекулярных структур, поэтому углеводы разделяют на простые (быстрые) и сложные (медленные). Больше всего простых углеводов содержат сахар, мед и мучные изделия, а основными источниками сложных углеводов являются крупы, овощи и фрукты.

Роль молекул в биохимических процессах (ДНК, ферменты)
Молекулы разных веществ вступают в реакции, в рамках которых они обмениваются атомами и обеспечивают жизнедеятельность любого организма, в том числе и человеческого. Каждый биохимический процесс имеет молекулярную природу. От состава, структуры и других свойств этих частиц зависят тип и особенности биохимических реакций. Взаимодействие молекул можно сравнить с работой людей в большой корпорации, где каждому из подразделений и отдельных сотрудников отведена собственная роль.
Ферменты — это белковые молекулы, которые выполняют функцию биологических катализаторов, ускоряя химические реакции и снижая сопутствующие затраты энергии. Ферменты воздействуют на крупные молекулы (субстраты) и преобразуют их в более простые молекулярные соединения, а именно в полезные вещества, которые усваиваются организмом. Каждый фермент работает с субстратом определенного типа. Например, амилаза расщепляет сложные углеводы на простые сахара, в частности, глюкозу. Далее в процессе гликолиза сразу несколько ферментов ускоряют дальнейшее расщепление молекулы, в результате которого организм получает энергию.
Молекулы ДНК (дезоксирибонуклеиновой кислоты) представляют собой сдвоенные спиральные цепочки, состоящие из нуклеотидов. Нуклеотиды — это соединения с азотным основанием, углеводами и фосфатами. В ДНК существует 4 типа азотных оснований: гуанин, аденин, тимин и цитозин. Они выстраиваются друг за другом в строго определенной последовательности и таким образом кодируют всю генетическую информацию. В каждой клетке организма содержится 46 молекул ДНК, формирующих 23 пары хромосом. Когда клетке необходимо выработать определенный фермент, она берет информацию из молекулы ДНК, синтезирует ее копию в виде молекулы РНК (рибонуклеиновой кислоты), после чего возникает биохимическая реакция.
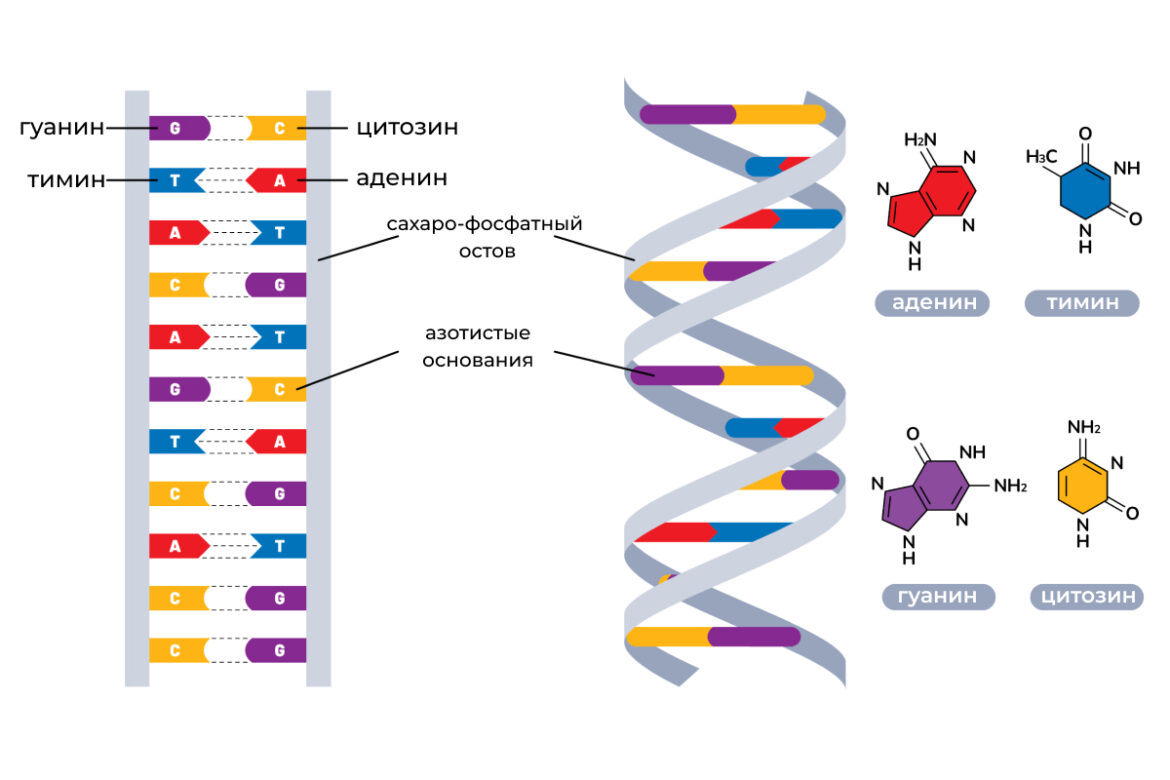
Молекулы лекарств и их воздействие на организм
Лекарства содержат молекулы веществ, которые воздействуют на «биологические мишени» — рецепторы клеток, ферменты, транспортные белки или нуклеиновые кислоты. Запуская последовательность биохимических реакций, лекарства могут как активировать молекулы в организме, так и подавлять их активность. Например, аспирин блокирует фермент циклооксигеназу, снижая чувствительность болевых рецепторов и замедляя воспалительные процессы. Одна и та же лекарственная молекула может взаимодействовать сразу с несколькими типами белков, поэтому терапевтическое воздействие лекарств нередко сопровождается побочными эффектами. Спустя определенное время молекулы лекарств выводятся из организма через почки, и их лекарственный эффект прекращается.
Молекулы воздуха: кислород, азот, углекислый газ
Самым распространенным газом в земной атмосфере является азот, составляющий в ней порядка 78%. Молекулы азота состоят из двух атомов этого элемента — N2. Между ними возникает тройная ковалентная связь, которую очень трудно разорвать. Этот газ достаточно инертен и в обычных условиях не вступает в реакции с другими веществами. Его главная функция при дыхании — разбавлять кислород, снижая интенсивность окислительных процессов. При высокотемпературном горении возникают оксид и диоксид азота — токсичные вещества, представляющие опасность для организма. Они, как правило, входят в состав так называемых «кислотных дождей».
Двухатомные молекулы кислорода — O2 — составляют немногим более 20% воздуха как по объему, так и по массе. Все живые существа за исключением бактерий и одноклеточных микроорганизмов нуждаются в кислороде. При дыхании он вступает в реакции окисления с органическими веществами, в результате чего запускаются процессы метаболизма и выделяется энергия. Кроме того, без окисления был бы невозможен процесс горения. Молекулы кислорода разрывают связи в молекулах топлива, благодаря чему высвобождается тепловая и световая энергия.

Приблизительно 0,04% молекул воздуха приходится на углекислый газ — CO2. Это химическое соединение из атома углерода, дважды ковалентно связанного с двумя атомами кислорода. Углекислый газ является побочным продуктом аэробного дыхания и сжигания топлива, то есть он возникает при окислении органических веществ. Он высокотоксичен — при концентрации молекул углекислого газа в воздухе свыше 5%, даже при достаточном уровне кислорода, удушье может наступить за считанные минуты. Вместе с тем углекислый газ необходим растениям, которые поглощают его при фотосинтезе и выделяют кислород в качестве побочного продукта.
Исследование и изучение молекул
Молекулярная концепция зародилась значительно позже, чем атомные теории, которые развивались еще в античные времена. Ее предшественником считается британский ученый Роберт Бойль, который в 1661 году опубликовал свою книгу «Скептический химик». В ней он выдвинул гипотезу о том, что мельчайшие частицы, корпускулы, формируются в скопления, и в результате перегруппировки их структуры происходят преобразования материи. Спустя век еще один британец, Уильям Хиггинс, предвосхитил концепцию валентности, предположив, что количество комбинаций частиц должно иметь пределы.

Собственно термин «молекула» в 1811 году ввел итальянский химик Амедео Авогадро. Согласно его гипотезе газы не обязательно состоят из отдельных атомов, а могут быть представлены их группами, объединенными силами притяжения в молекулы. Не имея способов проверить свои расчеты на практике, Авогадро также понял, что в равных объемах газов содержится одинаковое количество молекул. Впоследствии эта константа была рассчитана и принята как число Авогадро — 6 * 1023 молекул на моль или порцию вещества.
На протяжении XX века молекулярная теория развивалась благодаря достижениям квантовой физики и химии. В 1926 году существование молекул было окончательно доказано экспериментальными методами, вскоре после чего ученые на практике подтвердили гипотезы о ковалентных и ионных связях, дипольных силах притяжения и характере взаимодействия электронных оболочек.
Методы анализа молекул: масс-спектрометрия, хроматография, рентгеновская кристаллография
Масс-спектрометрия — это научный метод, который позволяет с высокой точностью определить массу молекул и их структуру, чтобы понять химический состав вещества. В рамках процедуры образец твердого, жидкого или газообразного вещества ионизируется под воздействием электронных пучков. При этом некоторые молекулы распадаются на положительно заряженные фрагменты, на которые воздействуют электрическим или магнитным полем. По характеру отклонения ученые рассчитывают отношение массы к заряду. Ионы обнаруживают детекторы заряженных частиц, которые сканируют сигналы и предоставляют результаты в виде спектра, то есть линий различной интенсивности.
Хроматография — это метод разделения смеси веществ на отдельные компоненты. Для этого образец помещают в подвижную фазу — газ или жидкость, которые выполняют функции растворителя. Затем его перемещают вдоль стеклянной или стальной трубки с закрепленной неподвижной фазой — твердым материалом или пленкой жидкости. В результате одни молекулы распределяются по неподвижной фазе, а другие выходят из колонки вместе с растворителем. С помощью хроматографии ученые могут определять химический состав и концентрацию различных веществ в смеси.
Рентгеновская кристаллография — это совокупность методов, позволяющих определить атомную или молекулярную структуру кристаллических тел. Все они основаны на свойстве рентгеновских лучей дифрагировать, то есть изменять направление под воздействием электронов в атомах. Измеряя углы и интенсивность дифракции, ученые получают трехмерную картину распределения атомов, их размеры и характеристики химических связей. Несмотря на название, такие методы используются не только для изучения кристаллов. Они помогли выявить структуру молекул нуклеиновых кислот, белков и витаминов.
Современные технологии в изучении молекул: квантовая химия, компьютерное моделирование
Квантовая химия — это раздел науки, в рамках которого ученые изучают возможность применения законов квантовой механики к химическим соединениям, и в частности молекулам. Именно благодаря квантовой химии появились методы изучения молекул на атомном уровне. Интересно, что большинство квантово-химических методов являются теоретическими, то есть не основанными на эмпирических данных. Предсказывая электронную структуру молекул и молекулярных структур, ученые получают возможность открывать сложные химические реакции и рассчитывать термодинамические свойства веществ.

Квантовая химия получила значительный импульс с развитием компьютерных технологий. Мощные вычислительные системы дают возможность создавать высокоточные симуляции, одновременно учитывающие колоссальные объемы данных. В современном мире цифровые эксперименты существенно ускоряют технический прогресс и экономят время на разработку лекарств, сверхпроводящих материалов, микроскопических электронных чипов и многого другого.
Перспективы и будущее молекулярной науки
Есть все основания полагать, что в будущем молекулярная наука поспособствует новым открытиям в биохимии, генетике и биоинформатике, а также прогрессу в медицине, нанотехнологиях и электронике. Определяя причину заболеваний на молекулярном уровне, врачи смогут разрабатывать персонализированные методы лечения с учетом генетических особенностей человека. Генетическая модификация растений поможет повысить их сопротивляемость болезням и неблагоприятным климатическим условиям, что положительно скажется на урожайности. В перспективе органические молекулы могут полностью заместить кремниевые полупроводники, одновременно повысив энергоэффективность и стоимость технических устройств.
Автор текста Иван Стефанов
Изображение на обложке: Freepik