Любая известная материя: мы с вами, предметы, газы, планеты и звезды — все состоит из атомов. Это одна из самых важных структурных единиц вещества. В прошлом атом считался мельчайшей и неделимой частицей, сегодня же мы знаем, что это не так, и у атомов также есть составные части. Ценность атомов заключается в том, что они, в отличие от еще более мелких субатомных частиц, позволяют точно идентифицировать тип вещества. Открытие их разнообразных свойств поспособствовало развитию науки, энергетики и медицины. Сегодня мы подробнее познакомимся с этими удивительными частицами, поговорим об истории изучения атомов и современных моделях и концепциях.
Что такое атом простыми словами?
Если говорить простыми словами, атом — это основной «строительный материал», из которого состоят все окружающие нас вещества. Подобно конструктору, атомы соединяются друг с другом в разных комбинациях и образуют молекулы. Например, молекула воды H20 состоит из двух атомов водорода и одного атома кислорода. Если же добавить к соединению еще один атом кислорода, получится пероксид, более известный как перекись водорода. Несмотря на то, что атомы чрезвычайно малы и их невозможно увидеть в обычный оптический микроскоп, у них также есть составные части — ядра и электроны, свойства которых мы рассмотрим подробнее чуть дальше.
Модели атомов: от древности до современности
В древности, за много веков до зарождения физики, изучением свойств материи занимались философы. В частности, древнеиндийская и древнегреческая философские школы предложили две очень похожие друг на друга концепции. Еще в VI веке до нашей эры последователи индийской школы вайшешика представили модель вечных и неделимых частиц «ану», что в переводе с санскрита означает «мельчайшее». Согласно учению, разные комбинации ану создавали не только материю и предметы, но также и свет, звуки и чувства. За управление движением ану отвечал Брахма — бог-творец в индуистской мифологии.
У древних греков была своя модель, предложенная Демокритом в V веке до нашей эры, — атомизм. Философ утверждал, что делить материю до бесконечности невозможно, поэтому она должна состоять из мельчайших частиц, которые он назвал «атомы», от древнегреческого «атомос» («ἄτομος») — «неделимый». В представлении Демокрита атомы отличались по размерам и формам, от которых зависели тип материи, вкусы, эмоции и даже особенности человеческой души. Спустя еще один век философ Эпикур развил идею атомизма. Он добавил, что атомы могут случайно отклоняться от изначальной траектории движения, объяснив тем самым свободу воли человека.
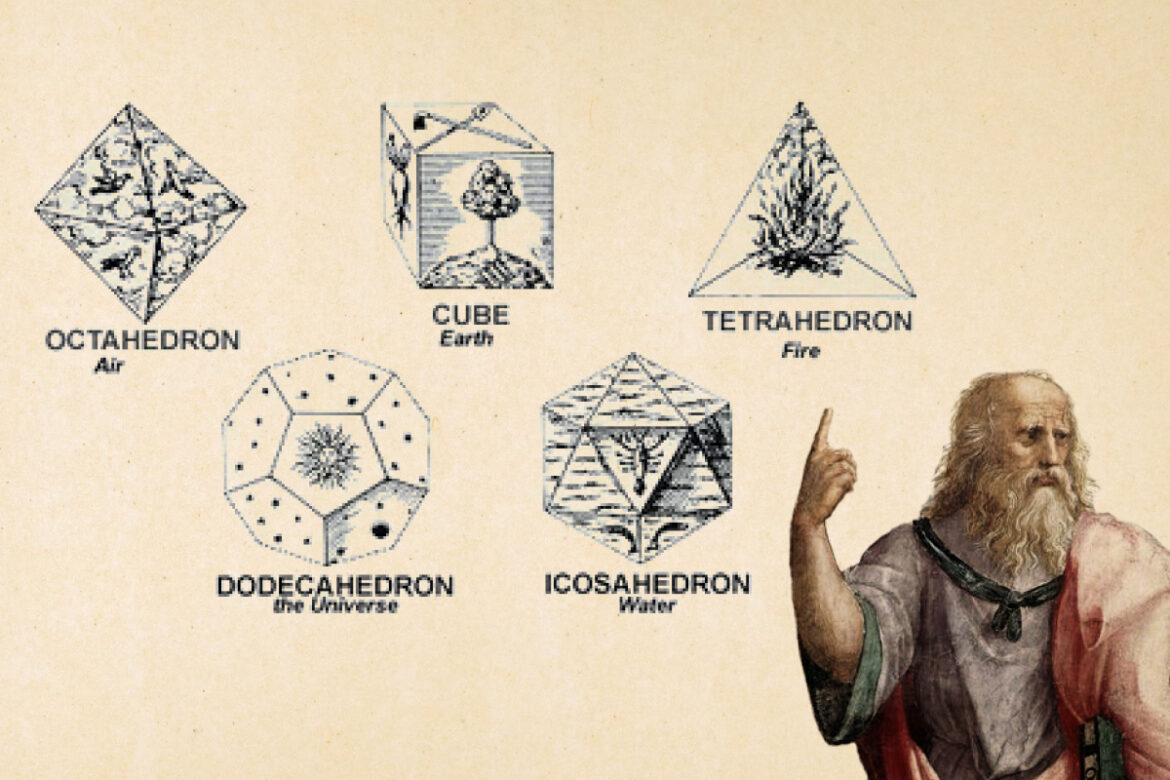
В том же V веке до нашей эры Платон настаивал на том, что столь красивый и упорядоченный мир не мог возникнуть из-за хаотического движения атомов, а потому у него есть создатель. Платон создал модель геометрических простых тел, в которой каждой стихии приписывалась определенная форма:
- огонь — пирамида-тетраэдр (4 грани);
- земля — куб (6 граней);
- воздух — октаэдр (8 граней);
- вода — икосаэдр (20 граней).
С наступлением Средневековья (около V века нашей эры) теории атомизма Демокрита и Эпикура были отвергнуты, так как противоречили христианской доктрине о бессмертии души. В Европе общепринятой стала модель Аристотеля с непрерывной материей и отсутствием пустого пространства. Аристотель утверждал, что материя — это первичная и однородная сущность, а разница между объектами объясняется тем, что материя принимает разные формы. Однако атомизм стал важной частью исламского богословия VIII – XII веков. Мыслители утверждали, что Аллах ежесекундно творит атомы в различных комбинациях, постоянно пересобирая материю, что позволяло объяснить божественные чудеса.
В Европе возрождение атомных теорий произошло в XVII веке, чему в значительной степени способствовали такие ученые, как Рене Декарт и Роберт Бойль. Декарт не отвергал модель непрерывной материи, однако утверждал, что вследствие ее движения по замкнутым линиям образуются мельчайшие частицы — корпускулы. Бойль, ставший одним из основоположников современной химии, предполагал, что различные свойства веществ объясняются разницей в форме и строении корпускул. При этом химические реакции являются следствием перегруппировки частиц.

Классическая атомная теория, которая стала переходным этапом на пути к современной модели, сформировалась в XIX веке. Ее основоположником считается английский ученый Джон Дальтон, которому удалось получить первые экспериментальные доказательства существования атомов. Проводя опыты с газами и жидкостями, он показал, что однородное вещество состоит из идентичных мельчайших элементов, одинаковых по массе и размеру. В одном из таких экспериментов Дальтон заполнял емкость смесью различных газов, а затем взвешивал как саму смесь, так и все ее компоненты по отдельности. Результаты показали, что при одном и том же объеме одинаковые газы имеют одинаковую массу, что свидетельствовало об идентичности их структуры.
Завершая историю развития атомных моделей мира, необходимо рассказать о заслуге российского ученого Дмитрия Менделеева. Согласно открытому им закону свойства химических элементов (металличность, неметалличность, электроотрицательность) меняются периодически, с возрастанием их атомной массы. Увидеть эту закономерность можно в известной всем со школьной программы таблице Менделеева. Российский ученый упорядочил элементы в соответствии с их свойствами, чем связал эмпирическую химию с атомной физикой.
Строение атома: основные компоненты
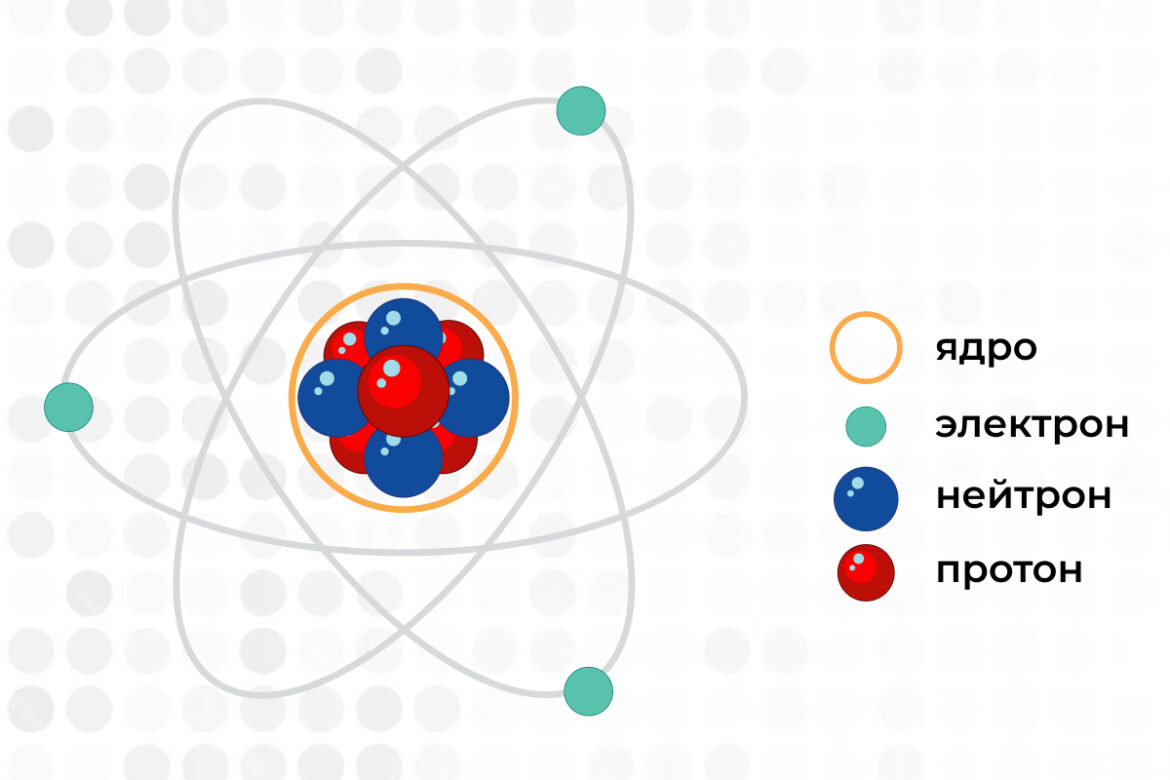
Еще в конце XIX – начале XX века ученым удалось установить, что атом, вопреки своему названию, не является неделимым, а состоит из еще более малых субатомных частиц. И сейчас мы поговорим об особенностях ядер атомов, состоящих из протонов и нейтронов, а затем перейдем к электронам.
Протон — частица с положительным зарядом. От количества протонов в ядре атома зависит его атомный номер или заряд ядра атома. От этого показателя зависит притягивающая электростатическая сила атома — чем больше протонов, тем больше ядро атома может притянуть электронов, и наоборот. Название «протон» происходит от древнегреческого слова «протос» («πρῶ-τος»), что означает «первый». Это связано с тем, что Эрнест Резерфорд в 1919 году открыл протон в атомах водорода — первого элемента таблицы Менделеева.
Второй компонент ядра атома, нейтрон, не имеет заряда, то есть является электрически нейтральным. Основная функция нейтронов — скреплять ядра атомов, предотвращая их распад. Это связано с тем, что положительно заряженные протоны проявляют не только притягивающую силу по отношению к электронам, но и стремятся оттолкнуться друг от друга за счет одинакового электрического заряда. Изотоп атома — это разновидность одного и того же вещества с разной степенью устойчивости ядра атома, которая зависит от количества нейтронов и их соотношения с протонами.
Из чего состоят субатомные частицы
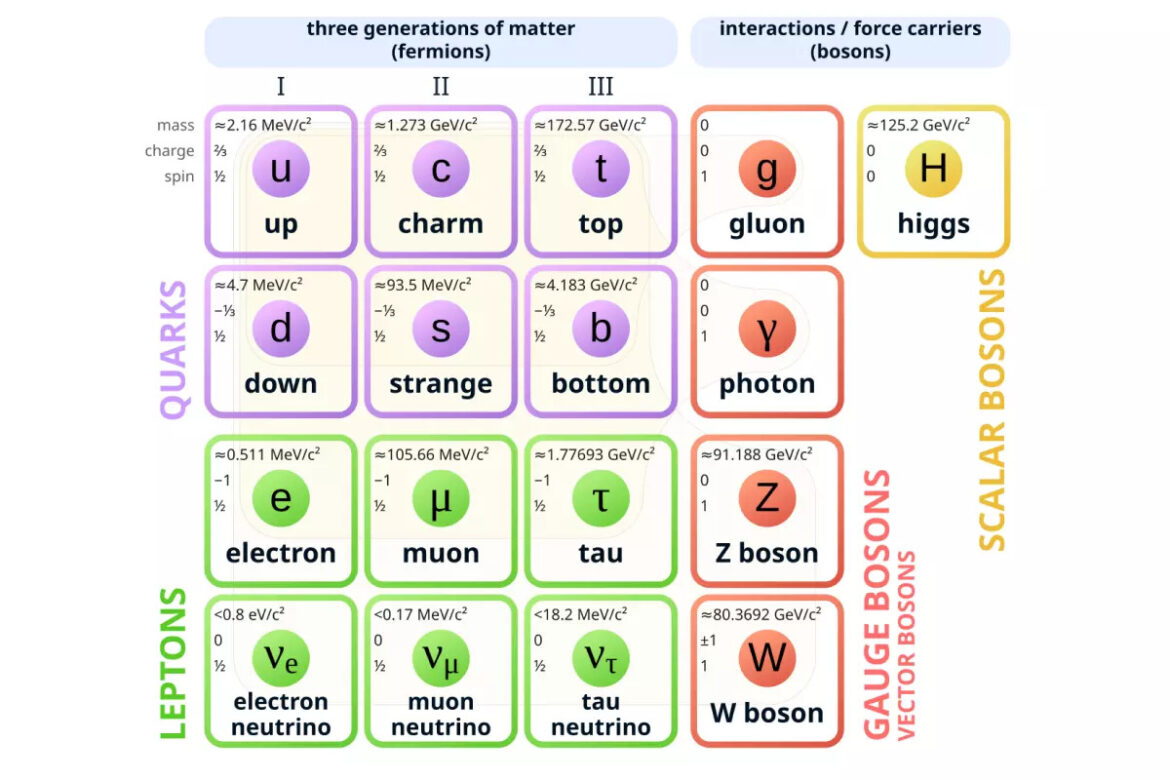
В современной физике и химии компоненты ядер атомов, протоны и нейтроны, называют нуклонами. До 1960-х годов считалось, что нуклоны являются элементарными неделимыми частицами (такими же, как в прошлом считались атомы). Однако такие ученые, как Роберт Хофштадтер, Мюррей Гелл-Манн и Джордж Цвейг рассчитали, что нуклоны также должны иметь внутреннюю структуру. Открытые сначала лишь теоретически, составные части протонов и нейтронов назвали «кварки». Такое название является шутливой отсылкой к роману Джеймса Джойса «Поминки по Финнегану», герой которого хотел заказать три кварты пива (6 пинт), но по ошибке заказал «три кварка».
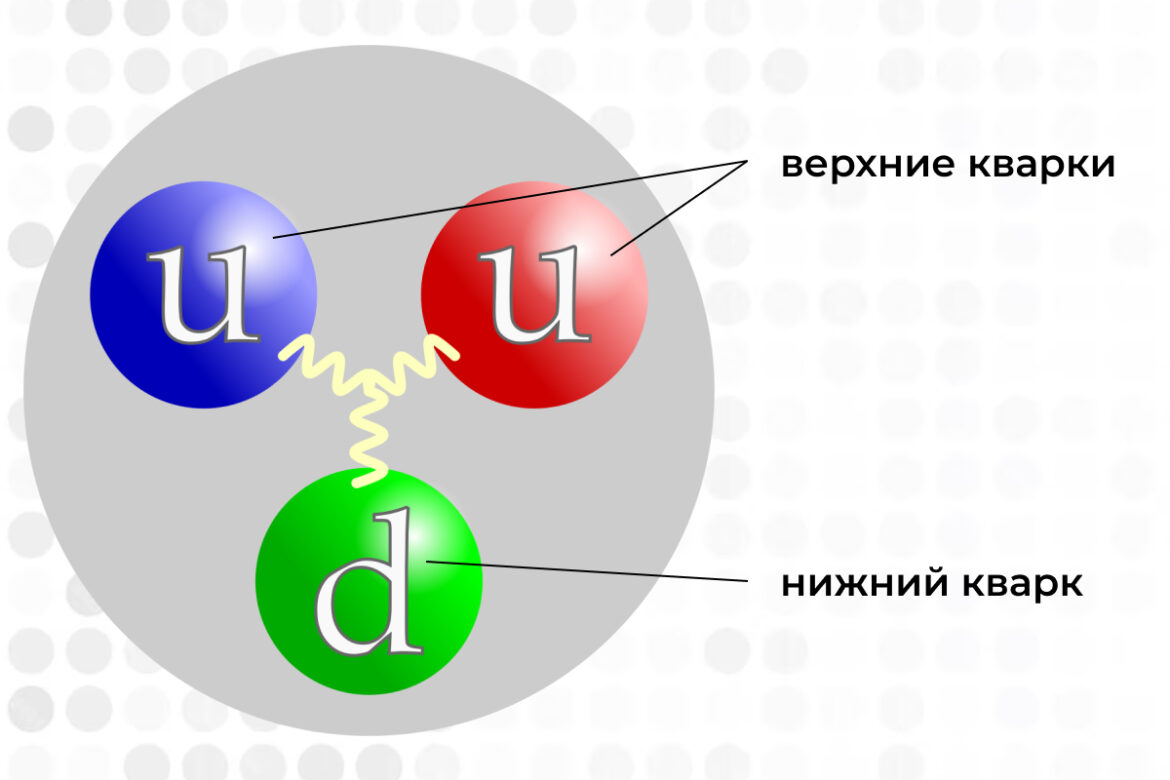
Именно из трёх кварков состоит каждый нуклон: протон — из двух верхних и одного нижнего, а нейтрон — наоборот. Верхние кварки являются самыми легкими и имеют положительный заряд (+frac{2}{3}), нижние кварки тяжелее и имеют отрицательный заряд (-frac{1}{3}). Таким образом, мы можем видеть, как, исходя из разных комбинаций кварков, определяются электрический заряд (или его отсутствие) нуклона. Посредством экспериментов на ускорителях заряженных частиц в 1970-х существование кварков было подтверждено, что положило начало Стандартной модели физики.
Электроны в атоме: свойства и поведение
В структуру атомов входят не только их ядра, но и электроны. В современном понимании электроны представляют собой элементарные неделимые частицы. Они имеют отрицательный заряд и составляют всего около 0,0006% от массы атома. Если подходить к вопросу упрощенно, электроны движутся вокруг ядра атома за счет разности электрических зарядов. Для того чтобы лучше представить этот процесс, можно провести аналогию со звездами и движущимися по орбитам вокруг них планетами. Именно «планетарную» атомную модель в 1910-х годах предложили Эрнест Резерфорд и Нильс Бор. Однако вскоре было установлено, что мельчайшие частицы не подчиняются законам классической механики, и планетарная модель была вытеснена квантово-механической, о которой мы чуть позже тоже поговорим.
Ионизация и электроотрицательность атома
В обычном состоянии атом имеет нейтральный электрический заряд, так как протоны и электроны уравновешивают друг друга. Однако если атом теряет или приобретает электроны, он становится частицей с электрическим зарядом — ионом. Положительная ионизация, то есть процесс потери одного или нескольких электронов, происходит под воздействием внешней энергии. Рассмотрим некоторые примеры положительной ионизации атомов:
- Фотоионизация. Если фотоны (элементарные частицы света), обладающие достаточно высокой энергией, взаимодействуют с атомом, они могут выбить из него электрон. В результате атом приобретает положительный заряд. Например, в верхней части атмосферы Земли ультрафиолетовые и рентгеновские лучи от Солнца ионизируют атомы газов, образуя особенный слой — ионосферу.
- Термическая ионизация. Когда атомы нагреваются до достаточно высокой температуры, они начинают двигаться быстрее (повышается их кинетическая энергия). Сталкиваясь друг с другом на высокой скорости, атомы могут терять электроны. Для термической ионизации необходимы экстремальные условия — например такие, как в солнечной плазме, где температура может достигать 15 млн °C.
- Ударная ионизация. Если атомы разгоняются достаточно быстро и сталкиваются с другими быстро движущимися частицами, сильное физическое взаимодействие может привести к потере электрона. В естественной среде ударная ионизация происходит во время грозы. Между облаками и поверхностью Земли образуется сильное электрическое поле, разгоняющее электроны. При столкновении с ними атомы воздуха ионизируются и образуется плазма — проводящая среда для разряда молнии.
Процесс, когда атомы приобретают дополнительные электроны и, как следствие, отрицательный заряд, называется отрицательной ионизацией. Эта возможность определяется электроотрицательностью атомов, то есть их способностью присоединять электроны. Самой высокой электроотрицательностью обладают атомы галогенов — например, фтора, малые размеры которого позволяют ему эффективнее притягивать электроны. Наименее электроотрицательными являются щелочные металлы с высоким диаметром атомов — цезий и франций.
Свойства атома: размер и масса
Мы уже упомянули о том, что атомы имеют крошечные размеры — в среднем не более 100 пикометров (10-12 метров). Для обозначения диаметра атома даже ввели специальную внесистемную единицу измерения — ангстрем. Давайте попробуем представить, насколько это мало, с помощью аналогий.
- Если увеличить апельсин до размеров Земли (диаметр 12 742 километра), один атом на его поверхности будет иметь диаметр не больше вишни (около 1 сантиметра).
- Диаметр сечения человеческого волоса составляет несколько десятых долей миллиметра. Диаметр атома примерно в миллион раз меньше человеческого волоса.
- В одной песчинке содержится в миллионы раз больше атомов вещества, чем звезд в галактике Млечный Путь.
При этом, даже несмотря на столь малые размеры, большую часть строения атома составляет пустота. Если вообразить его в виде футбольного стадиона, ядро из нуклонов будет располагаться в центре поля, а электроны — вращаться на границах стадиона.
Почти вся масса атома сосредоточена в его ядре, так как электрон примерно в 1 800 раз легче, чем нуклон. Так как протоны и нейтроны имеют примерно одинаковую массу, их суммарное количество называют массовым числом атома. Для полного осознания массы атома не совсем подходит даже аналогия с песчинкой. При массе в 1 миллиграмм она будет в 1018 (квинтиллион) раз тяжелее, чем атом. Однако даже при столь ничтожной массе от атомов и составляющих их частей зависит массивность любых объектов во Вселенной.
Квантово-механическая модель атома: ключевые аспекты
Сначала немного отвлечемся от структуры атома и разберемся с термином «квант». Еще в 1905 году Альберт Эйнштейн, изучая фотоэффект (фотоионизацию), доказал, что свет ведет себя не только как волна, но и как поток частиц (фотонов), что положило начало корпускулярно-волновому дуализму. Согласно этой модели, потоки микрообъектов одновременно имеют характеристики как частиц (энергию и импульс), так и волн (длину и частоту). Физикам удалось установить, что энергия излучается не непрерывно, а определенными порциями, соответствующими волновым характеристикам. Одна такая порция энергии получила название «квант», от латинского «quantum» — «сколько».
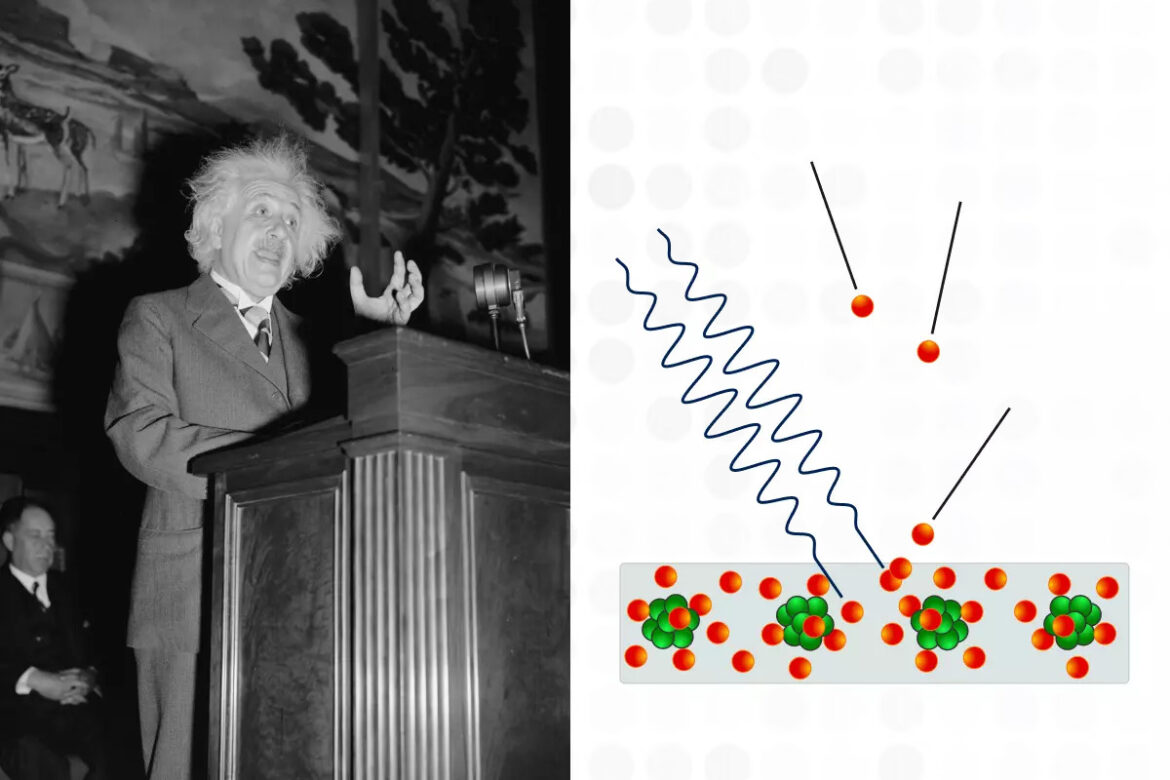
В 1920-х годах физики обнаружили, что на субатомном уровне материя ведет себя странным образом, не подчиняясь классическим законам физики. В главенствующей на то время планетарной модели Бора – Резерфорда электроны двигались вокруг ядер атомов по стабильным траекториям — орбитам. Ученые поняли, что если бы это было так, электроны быстро теряли бы энергию из-за излучения и падали на ядро, однако атомы сохраняют свою стабильную структуру в течение очень долгого времени.
В 1924 году французский физик Луи де Бройль выдвинул гипотезу, согласно которой квантовые эффекты проявляют не только безмассовые фотоны, но и электроны, масса которых ничтожно мала. Из-за волновых свойств они попросту не могут двигаться по стабильным траекториям, как предсказывала планетарная модель. Основой новой квантово-механической модели стало уравнение Эрвина Шредингера, которое позволяло определить форму орбиталей (траекторий движения с учетом волновых свойств) и оценить, где именно на орбитали можно с большей вероятностью встретить электрон.
Энергетические уровни атома: как они работают
В соответствии с квантово-механической моделью, электроны могут находиться в разных состояниях: основном (с минимальным количеством энергии) и возбужденных (после поглощения определенного количества энергии), которых бывает несколько. В зависимости от этого показателя электроны могут двигаться по разным орбиталям, которые распределяются по определенным зонам — энергетическим уровням. Чем меньшей энергией обладает электрон, тем ближе он находится к ядру — располагается на более низком энергетическом уровне.
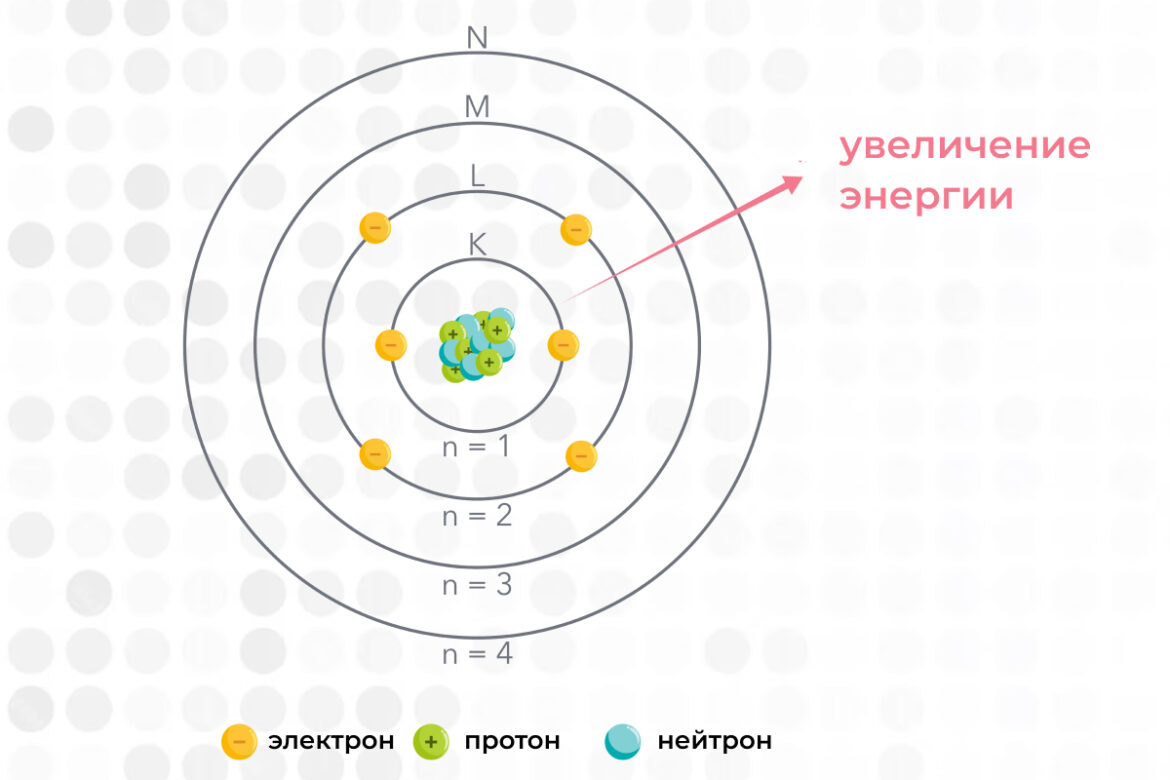
Поглощая или отдавая энергию, электроны моментально перемещаются на тот или иной уровень, но никогда не могут находиться в промежутке между ними. Характеристики энергетического уровня и его орбиталей определяются набором квантовых чисел.
- Главное (n) — количество энергии и размер уровня.
- Орбитальное (l) — форма орбитали.
- Магнитное (ml) — ориентация орбитали в пространстве.
- Спиновое (ms) — «вращение» электрона.
На каждом энергетическом уровне может быть строго определенное максимальное количество электронов, зависящее от квантового числа. Посчитать его можно по формуле N=2n². Таким образом, на первом уровне может находиться не более 2 электронов, на втором — не более 8, на третьем — не более 18, и так далее. Максимальное количество главных квантовых чисел определяется номером периода элемента в таблице Менделеева (от 1 до 7).
Магнитный момент атома: что это и зачем нужно
Магнитный момент атома позволяет объяснить природу магнетизма различных веществ. Он показывает, как атом взаимодействует с внешним магнитным полем в зависимости от свойств его электронов. Магнитный момент атома складывается из двух основных составляющих.
- Орбитальный магнитный момент — возникает из-за движения электрона вокруг ядра атома.
- Спиновый магнитный момент — возникает из-за собственного вращения электрона.
Спин некорректно представлять как классическое вращение объекта вокруг своей оси, это его внутренний показатель магнитного поля, или собственный момент импульса элементарной частицы. Объяснить природу спина нельзя с помощью законов классической физики, поэтому используют аналогию с вращением. Название термина происходит от английского слова «spin» — «вращать». К слову, такой же корень имеет и название популярной вращающейся игрушки – «спинер».
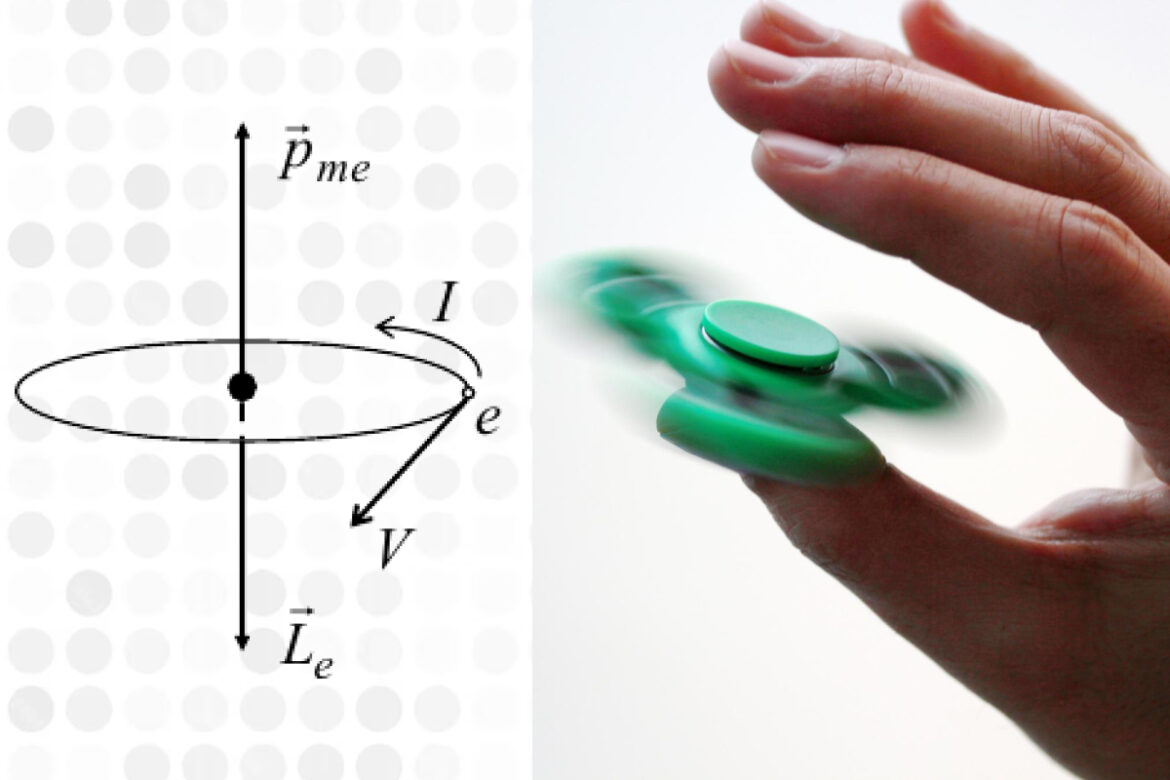
Теперь давайте разберемся, от чего именно зависит магнитный момент атома. Орбитальный и спиновый моменты представляются как векторные величины, то есть имеющие определенное направление. Если векторы направлены в разные стороны, они компенсируют друг друга, и магнитный момент атома оказывается близок к нулю (например, у инертных газов). Если же орбитальный и спиновый моменты не уравновешивают друг друга, атом обладает высоким магнитным моментом. Наиболее высок этот показатель у редкоземельных элементов (лантаноидов), железа и марганца.
Радиоактивный распад: причины и последствия
Радиоактивный распад является фундаментальным процессом в понимании радиации. У атомов разных химических элементов существуют изотопы — вариации с разным количеством нейтронов в ядре. При этом изотопы могут иметь как стабильные, так и нестабильные ядра. Последние называют радиоактивными. Если нейтроны не могут компенсировать электромагнитное отталкивание между протонами или ядро является слишком тяжелым (как у урана), оно имеет избыточную энергию и начинает распадаться, стремясь вернуться в стабильное состояние. Этот процесс сопровождается выплеском энергии в виде электромагнитного излучения.
Сейчас мы кратко рассмотрим основные типы радиоактивного распада.
- Альфа-распад. Ядро испускает альфа-частицы, эквивалентные ядрам гелия (по два протона и нейтрона). В процессе распада образуется новый изотоп с меньшим атомным номером. Поток альфа-частиц присоединяет к себе электроны других атомов и является сильным ионизирующим излучением.
- Бета-распад. При дисбалансе протонов и нейтронов себя проявляет слабое взаимодействие — одна из фундаментальных сил природы. Чтобы стабилизировать ядро, оно меняет тип кварков, превращая протоны в нейтроны, и наоборот. В первом случае испускаются позитроны и нейтрино, а во втором — их античастицы, электроны и антинейтрино. Поток бета-частиц имеет более высокую проникающую способность и оказывает более сильное ионизирующее воздействие.
- Гамма-распад. Когда ядро атома переходит из возбужденного состояния в основное, оно испускает высокоэнергетические фотоны, которые называют гамма-лучами. Как правило, гамма-распад следует за альфа- и бета-распадом, если после них ядро остается в возбужденном состоянии. Гамма-излучение обладает самой высокой проникающей и поражающей способностью.

Радиоактивный распад может иметь как позитивные, так и негативные последствия. Он используется для производства ядерной энергии, медицинского сканирования и стерилизации оборудования. В то же время высокие дозы радиационного излучения поражают организм человека, загрязняют окружающую среду и наносят серьезный ущерб экосистемам.
Валентность: значение для химических связей
Валентность — это одно из ключевых свойств атома в области химии. Она показывает, какое количество химических связей может быть у атома с другими атомами или группами атомов. Как и во многих других случаях, это свойство определяется электронами. Самый высокий энергетический уровень атома называется внешней электронной, или валентной оболочкой, а электроны, которые на нем находятся, — валентными. Валентность показывает, сколько электронов атом способен принять или отдать при образовании химической связи.
Возьмем простой пример с молекулой воды H20. Кислород имеет валентность II, а водород — I. Соответственно, два атома водорода могут образовать связь с одним атомом кислорода. Однако в начале статьи мы упоминали пероксид, молекула которого имеет по два атома водорода и кислорода. Чтобы понять, как такое возможно, представьте пероксид в виде химического соединения H-O-O-H. Как можно видеть, атомы кислорода образуют по две связи, а атомы водорода — по одной, поэтому принцип валентности не нарушается.

Дисперсионное притяжение: что влияет на взаимодействие атомов
Дисперсионное притяжение — это особый вид межатомного взаимодействия, который в 1930 году открыл немецкий физик Фриц Лондон. Как мы знаем, электроны постоянно движутся вокруг ядра атома и могут находиться на определенной части орбитали с некой вероятностью. В результате этого движения электроны могут кратковременно скапливаться на одной стороне орбитали, из-за чего она становится отрицательной, а противоположная сторона — положительной (из-за положительно заряженных протонов). Так возникает временный дипольный момент — если положительный диполь одного атома взаимодействует с отрицательным диполем другого, они притягиваются друг к другу.
На вероятность возникновения диполя влияет поляризуемость атома, то есть способность перераспределять электроны под воздействием внешнего электрического поля. Если эта способность высока, происходит деформационная поляризация атома, и дисперсионное притяжение проявляется с большей вероятностью. Дисперсионное притяжение усиливается, если взаимодействуют атомы крупных молекул, и ослабевает при увеличении расстояния между ними.







