Амилоиды и прионы — словно два варианта одного и того же кошмара, который может развернуться прямо внутри клетки. Оба начинаются с маленькой ошибки в складке белка, но заканчиваются разрушительными цепными реакциями, меняющими мозг и тело до неузнаваемости. Как два лица одной молекулярной катастрофы, они показывают, что иногда самые опасные враги угрожают организму не извне, а из глубин его собственной биохимии.
Когда белки ломают правила игры
Белки в нашем организме — это «рабочие лошадки» клетки, молекулы, которые почти строят, защищают, переносят, регулируют. Но так бывает не всегда: стоит одному из белков принять ошибочную форму, как стандартная биохимическая логика дает сбой: молекула, которая должна была помогать клетке, становится бесполезной или даже опасной.
История изучения амилоидов и прионов — это череда неожиданных открытий. В конце XIX века патологи впервые обнаружили в тканях умерших людей необычные «крахмалоподобные» отложения и назвали их амилоидами (прим. ред.: название происходит от латинского amylum и греческого amylon— крахмал), предполагая, что они представляют собой смесь углеводов. Лишь позднее выяснилось — данные структуры образованы неправильно свернувшимися белками. А еще позже ученые выяснили: именно с неправильным «складыванием» белков связаны, например, болезни Альцгеймера, Паркинсона, прионные заболевания, такие как губчатая энцефалопатия крупного рогатого скота, более известная как «коровье бешенство», скрепи у овец и коз (прим. ред.: прионное заболевание, поражающее нервную систему и приводящее к зуду, нарушению координации и гибели животных), болезнь Крейцфельда-Якоба у человека.
В 1980-х годах американский врач Стэнли Прузинер выдвинул революционную идею о том, что некоторые заболевания могут распространяться не через бактерии или вирусы, а за счет передачи патологически измененной формы белка. То есть без ДНК, РНК или генов. Поначалу его теорию встретили скептически, однако годы экспериментов показали, что так называемые «белки-зомби» действительно существуют. Эти аномально свернутые белки способны передавать информацию о своей неправильной структуре другим, нормальным белкам, и тем самым заставлять их менять форму. Такой механизм называют прионоподобным: то есть белки ведут себя как прионы, но формально ими не считаются и не связаны с прионной инфекцией. Именно это сходство позволяет сегодня рассматривать болезнь Паркинсона и болезнь Альцгеймера как разные проявления общего класса заболеваний, в основе которых лежит сбой в структуре и поведении белков.

Так появилась новая область исследований — наука о прионоподобных и амилоидных белках, объединяющая методы структурной биологии и биофизики и направленная на изучение того, как изменения формы белков влияют на их поведение в организме.
Амилоиды: мусор, который мозг не успевает убирать
Амилоиды — особый класс белковых агрегатов, то есть отложений, которые образуются тогда, когда обычные белки теряют свою правильную трехмерную форму. В нормальных условиях белок, синтезированный в клетке, сворачивается в строго определенную структуру, и именно она позволяет белку выполнять свою функцию. Однако при сбое в этом процессе молекула обнажает участки, склонные к слипанию, и начинает притягивать к себе такие же неправильно свернувшиеся фрагменты. Со временем из отдельных молекул формируются длинные волокна и плотные отложения, отличающиеся необычайной стабильностью и устойчивостью к разрушению. Один из самых известных амилоидов — β-амилоид, который постоянно образуется в мозге в ходе нормальной работы клеток. В малых количествах он безопасен и является обычным продуктом обмена белков, но при избытке β-амилоид начинает неправильно соединяться с другими молекулами, образуя стабильные скопления и плотные отложения.
С возрастом или при сбое работы «санитарной службы» мозга, которая убирает лишние белки, равновесие нарушается. Лишний β-амилоид накапливается быстрее, чем мозг успевает его переработать. В результате появляются амилоидные бляшки, которые мешают нейронам общаться, тормозят передачу сигналов и разрушают связи между клетками. Кроме того, β-амилоид вызывает воспаление и нарушает питание нейронов, заставляя их работать в «аварийном режиме» и тем самым ускоряя гибель клеток. Представьте город, где дороги постепенно засыпают камнями — машины все еще есть, но проехать они не могут. Так и в мозге: сигналы тормозятся, связи разрываются, память тускнеет.
Однако болезнь Альцгеймера — не единственный пример того, как нарушение работы белков приводит к разрушению нервной системы. Схожие процессы лежат в основе и других нейродегенеративных заболеваний. В частности, при болезни Паркинсона ключевую роль играет другой белок — α-синуклеин. В норме он участвует в передаче сигналов между нейронами, но при болезни также начинает сворачиваться неправильно и образовывать скопления внутри клеток мозга. Эти скопления, известные как тельца Леви, повреждают нейроны и постепенно нарушают работу двигательных центров мозга. В итоге мозг, когда-то пластичный и живой, оказывается заблокирован собственными биохимическими обломками.
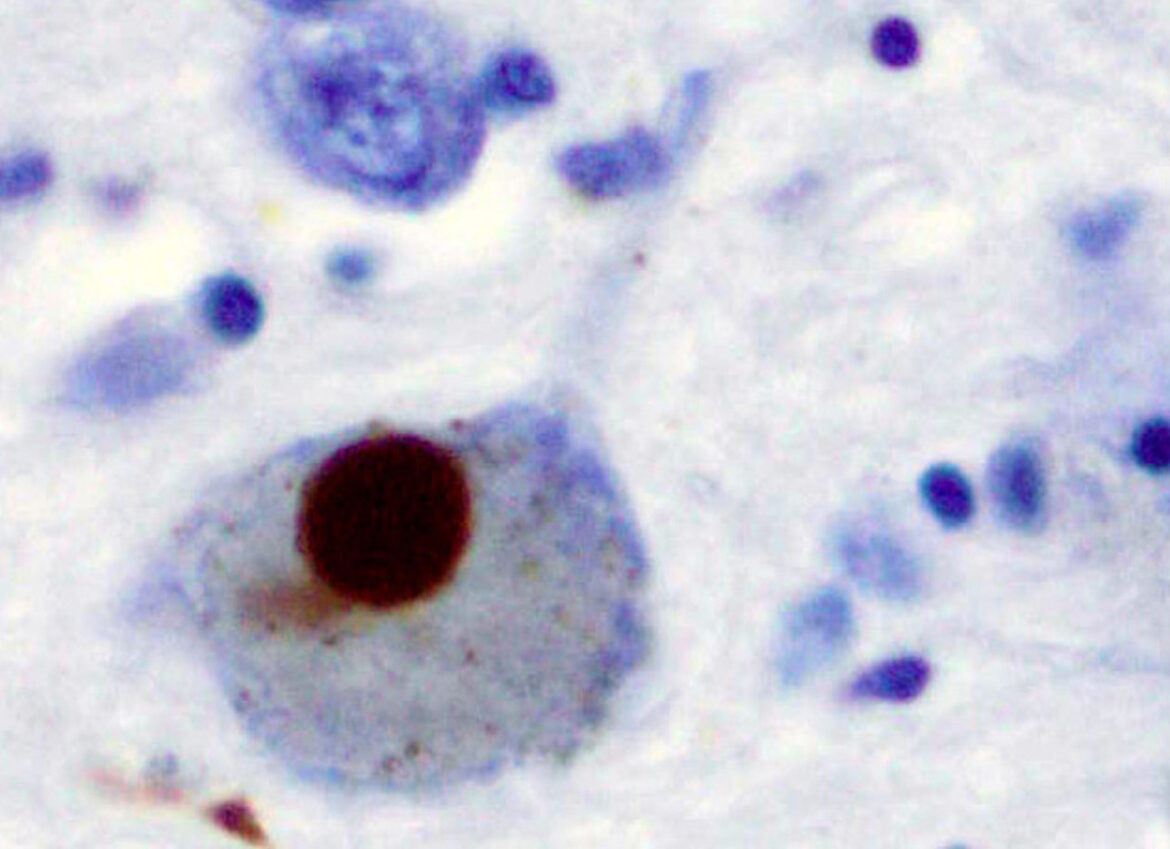
Изучение структуры амилоидов, их поведения и механизмов агрегации считается одним из ключевых направлений в понимании нейродегенеративных заболеваний и поиске способов их замедлить или остановить.
Прионы: белки, которые умеют «заражать» друг друга
Прионы (прим. ред.: от англ. prion от protein «белок» + infection «инфекция») занимают особое место среди заболеваний, связанных с белками. В отличие от амилоидов, которые в первую очередь представляют собой белковые отложения, прионы — это патологическая форма конкретного белка, способная распространять свое состояние. Такой белок не несет генетического материала, но может выступать «шаблоном», заставляя нормальные молекулы того же белка принимать опасную форму. Именно поэтому прионные болезни развиваются как цепная реакция и протекают особенно тяжело.
Прионные заболевания могут в редких случаях передаваться между организмами — например, при употреблении зараженных тканей животных или в результате медицинских процедур. Однако даже в этих случаях речь идет не об инфекции в классическом смысле, а о передаче уже измененного белка. Попав в организм, прионы со временем накапливаются в центральной нервной системе — прежде всего в головном мозге. Поражение мозга при прионных заболеваниях развивается медленно, но затем прогрессирует стремительно. Болезнь может проявиться спустя годы или даже десятилетия после контакта.
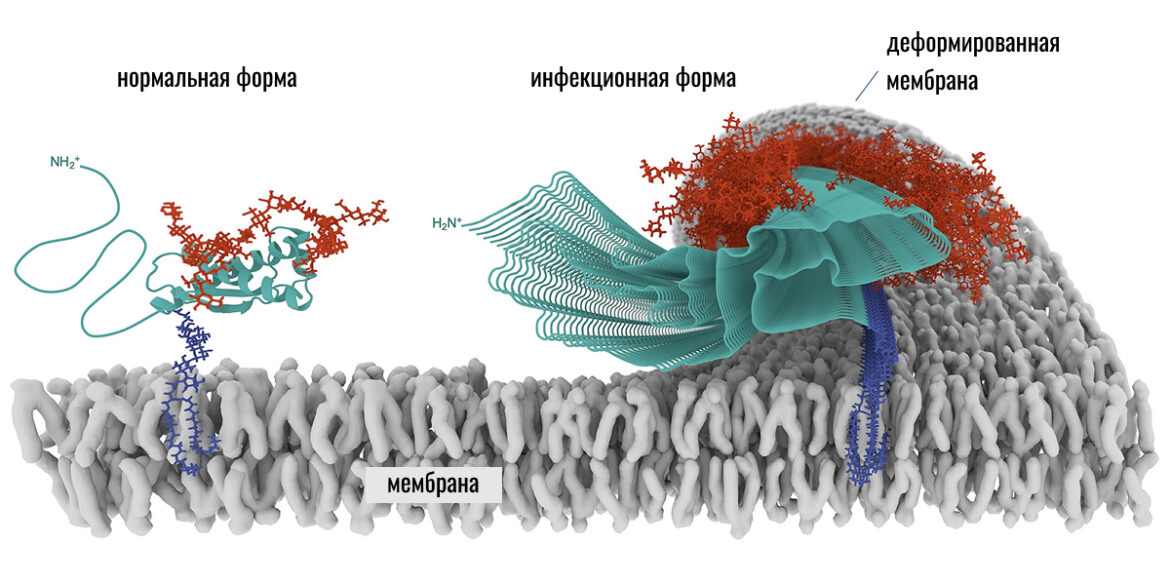
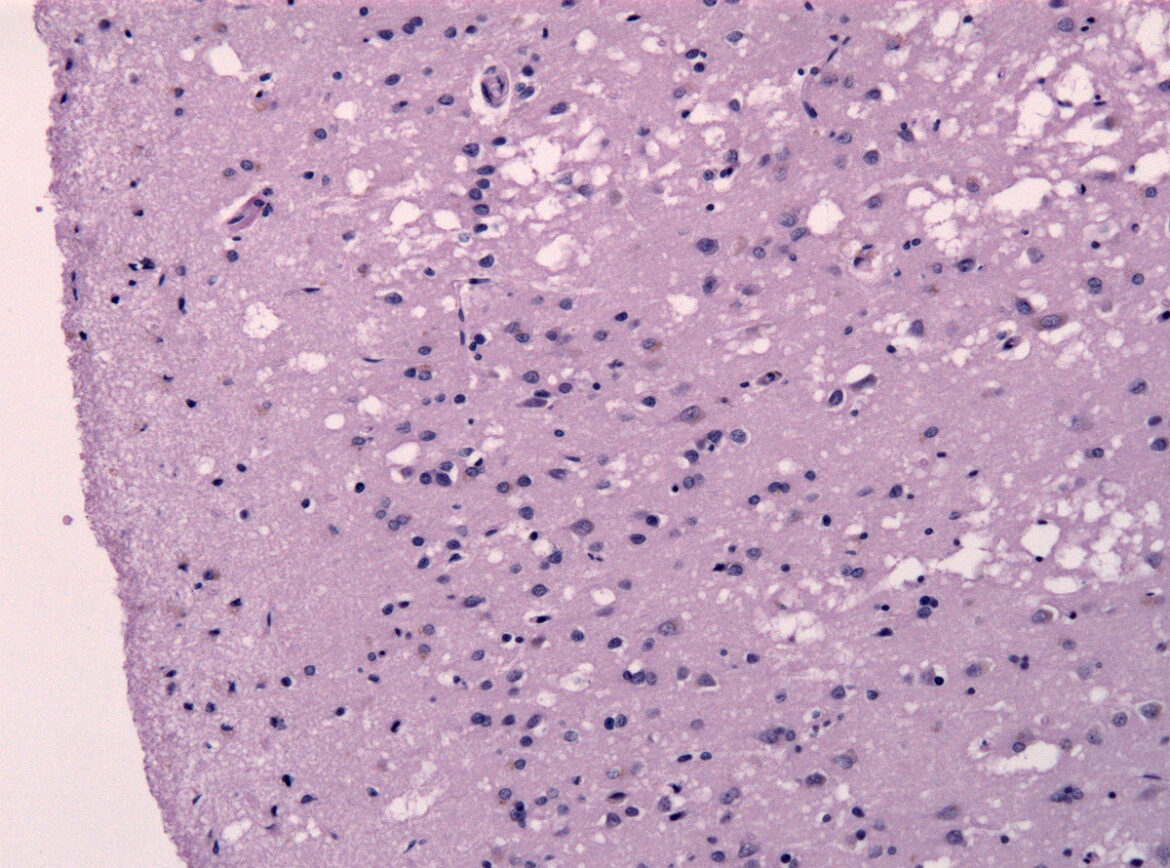
По мере накопления патологических прионов в мозге они образуют устойчивые агрегаты, разрушающие нервную ткань. Нейроны гибнут, между ними появляются пустоты, а ткань мозга приобретает характерную «губчатую» структуру. У человека это приводит к быстро прогрессирующей деменции, нарушению координации и утрате когнитивных функций. Классический пример — болезнь Крейцфельдта-Якоба, при котором прионы постепенно разрушают головной и спинной мозг, приводя к ухудшению памяти, движений и мышления.
Особую опасность прионов определяет их необычная устойчивость. В отличие от бактерий и вирусов, они не разрушаются при обычной стерилизации, выдерживают высокие температуры и воздействие многих химических веществ. Из-за этого прионы трудно уничтожить и проконтролировать. Это объясняет, почему прионные заболевания долгое время оставались загадкой для науки.
Белки под прицелом: новые стратегии лечения
Несмотря на десятилетия исследований, нейродегенеративные заболевания до сих пор остаются одной из самых трудных задач для современной медицины. Традиционные методы лечения часто дают ограниченный эффект, поскольку в основном направлены на облегчение симптомов, а не на устранение молекулярных причин болезни. Однако в последние годы ситуация начала меняться. Развитие молекулярной биологии, биотехнологий и искусственного интеллекта открыло путь к принципиально новым подходам в лечении. Сегодня речь идет уже не просто о создании отдельных лекарств, а о комплексных терапиях, способных точечно вмешиваться в патологические процессы и замедлять или даже останавливать развитие заболевания.
Например, российская фармацевтическая компания «Р-Фарм» вместе с Институтом AIRI и Сбером запустили совместный проект с использованием генеративного искусственного интеллекта (ИИ) по разработке лекарств от болезни Альцгеймера и других нейродегенеративных заболеваний. Проект представили на международной конференции, и он стал первым в России фармацевтическим консорциумом такого масштаба. Партнерство было официально оформлено летом 2025 года на ПМЭФ. Использование ИИ позволяет быстрее изучать заболевания на молекулярном уровне, подбирать перспективные лекарственные молекулы и существенно сокращать сроки и стоимость доклинических исследований. Сейчас ученые сосредоточены на разработке антител и систем доставки лекарств, способных преодолевать гематоэнцефалический барьер и доставлять препараты непосредственно в мозг, а это уже должно существенно повысить эффективность лечения.
Еще одним из примеров новых подходов к лечению нейродегенеративных заболеваний стало недавнее исследование, посвященное связи нейровоспаления и амилоидных процессов при болезни Альцгеймера. Ученые из Пущинского научного центра биологических исследований РАН совместно с коллегами из Университета Южной Флориды (США) изучили, как воспаление в мозге влияет на накопление токсичного белка β-амилоида, который считается главной причиной гибели нервных клеток и развития слабоумия.

Эксперименты показали, что специфические белки воспаления S100A8 и S100A9 активно связываются с самыми опасными формами амилоида. Однако, с одной стороны, это взаимодействие может повышать токсичность амилоида в определенных условиях. Но с другой, и это ключевой вывод, именно такое связывание мешает амилоиду собираться в крупные нерастворимые бляшки, которые и разрушают мозг. По сути, воспалительные белки «замораживают» токсичный белок в менее вредном состоянии, предотвращая формирование смертельных отложений.
Главный результат работы состоит в том, что ученые с высокой точностью определили, как именно и в каком месте эти белки сцепляются друг с другом. Это знание открывает прямую дорогу к разработке лекарств нового типа. Будущие препараты смогут целенаправленно усиливать защитную, «анти-бляшечную» сторону этого взаимодействия, подавляя при этом возможные риски.
Параллельно с поиском молекулярных мишеней для будущих лекарств развивается и другое важное направление — инструменты, позволяющие глубже понять, как именно амилоиды формируются и взаимодействуют друг с другом.
В этом контексте ученые Санкт-Петербургского университета совместно с исследователями Университета Монпелье (Франция) разработали первый в мире биоинформатический инструмент для поиска пар амилоидных белков, способных к коагрегации (прим. ред.: процесс совместного слипания разных белков в один смешанный комплекс). Новый метод, получивший название AmyloComp, демонстрирует точность более 94 % и уже описан в научном журнале Journal of Molecular Biology.
Амилоиды обычно состоят из одного белка, но иногда в них могут попадать другие. AmyloComp ищет такие совместимые участки, которые, хотя и отличаются по составу, все равно могут «вставать» в одну общую структуру.
Тесты показали, что программа хорошо распознает и реальные примеры совместной агрегации и случаи, когда белки не взаимодействуют. Это важно, потому что коагрегация белков может быть как вредной, то есть усиливать нейродегенеративные болезни, так и полезной — участвовать в нормальных процессах, например, в защите от вирусов.
Главное преимущество AmyloComp в том, что она учитывает не только схожесть белков, но и то, как они реально могут «ложиться» в общую структуру. Это преимущество позволит исследовать взаимодействия белков на уровне всего организма и открыть новые возможности для понимания как болезней, так и нормальной работы клеток.

****
Исследования амилоидов, прионов и взаимодействий белков открывают новые горизонты в понимании болезней мозга. Современные подходы объединяют экспериментальную биофизику, молекулярную биологию и искусственный интеллект, создавая платформы вроде AmyloComp, которые моделируют процессы агрегации белков на молекулярном уровне.
Амилоиды и прионы встречаются не только у человека, но и у животных, растений и микробов, где выполняют полезные функции. Болезнь часто возникает как искажение этих нормальных механизмов. Понимание тонких различий между безопасными и опасными формами белков открывает путь к целевым и безопасным терапиям.
Хотя путь от лаборатории до пациента еще длинный, современные методы дают надежду на вмешательство прямо в молекулярные процессы болезней, сохраняя мозг и память человека.
Автор текста Анастасия Будаева
Прионный белок. Изображение на обложке: Прионный белок, иллюстрация: PoopAcidMaker, CC BY-SA 4.0, via Wikimedia Commons







