Гражданские ядерные технологии давно вышли за пределы энергетики, превратившись в том числе в один из важных инструментов современной медицины. Сегодня «мирный атом» становится основой новых методов диагностики и терапии, которые меняют подход к лечению сложнейших заболеваний. О том, как работают эти технологии и какие возможности они открывают перед пациентами и врачами, рассказываем в этой статье.
Ядерная медицина – это область на стыке физики, химии и биологии, использующая для диагностики и лечения заболеваний радиоактивные изотопы. Ее главная цель – заглянуть глубже обычных методов исследования и воздействовать на болезнь максимально точно, не повреждая здоровые ткани.
Развитие ядерной медицины началось с простых наблюдений за поведением радиоактивных частиц и в итоге привело к созданию высокоточных технологий, которые сегодня позволяют увидеть болезнь еще до появления симптомов и лечить недуг точечно, на уровне молекул. Благодаря ядерной медицине врачи могут не только выявлять патологии на самых ранних стадиях, но и отслеживать эффективность терапии в реальном времени. Эволюция этой области шла по трем направлениям: диагностика, лечение и создание радиофармпрепаратов. Рассмотрим подробнее каждое.
Как работает лучевая диагностика
Основателем радиоизотопной диагностики считают венгерского ученого Дьёрдя Хевеши (1885-1966), который еще в 1913 году предложил использовать «меченые атомы» в биологических исследованиях и позже получил за это Нобелевскую премию.
В 1930-40-е годы ученые обнаружили, что радиоактивные изотопы могут служить своеобразными метками, которые ведут себя как обычные вещества в организме, но при этом излучают сигналы, заметные для специальных приборов. Это открытие буквально перевернуло представления врачей о диагностике.
В 1958 году в медицине появилась гамма-камера – прибор, способный «поймать» слабое излучение от введенных в организм радиоактивных меток. Разработка гамма-камеры стала настоящим прорывом: так родилась клиническая сцинтиграфия, с помощью которой можно наблюдать за работой органов в реальном времени.
В 1970–80-е годы ядерная медицина получила развитие благодаря появлению новых высокоточных методик. Однофотонная эмиссионная компьютерная томография (ОФЭКТ) впервые позволила получать трехмерные изображения распределения радиофармпрепарата в органах, а позитронно-эмиссионная томография (ПЭТ) дала возможность наблюдать обмен веществ и активность тканей.
Параллельно совершенствовалась и классическая лучевая диагностика: в 1970-е в клиническую практику вошла компьютерная томография (КТ), а в конце 1970-х – начале 1980-х появились первые аппараты магнитно-резонансной томографии (МРТ). Эти технологии давали врачам точные анатомические изображения, но не показывали функцию органов.

Именно поэтому в конце XX века возникли гибридные методы — ПЭТ/КТ и ОФЭКТ/КТ. Они объединили в себе преимущества структурной визуализации (КТ) и функциональной диагностики (ПЭТ или ОФЭКТ). Теперь врач мог видеть не только как выглядит орган, но и как он работает. Такой подход сделал диагностику значительно точнее — организм стал почти «прозрачным» — а выявление заболеваний возможным на самых ранних этапах.
Пациенту вводят небольшое количество радиофармпрепарата — вещества, в состав которого включен радиоактивный изотоп. Такой препарат специально создают так, чтобы он повторял свойства обычных молекул, которые организм использует каждый день. Поэтому молекулы с радиоизотопом движутся по тем же путям: попадают в кровь, распределяются по органам и накапливаются там, где в норме происходит нужный физиологический процесс. Изотоп испускает слабое излучение, которое улавливают чувствительные детекторы гамма-камер, ОФЭКТ или ПЭТ-сканеров. Прибор фиксирует каждый зарегистрированный квант излучения и превращает набор точек-сигналов в изображение. В результате врач получает карту распределения препарата в организме, с помощью которой может увидеть, как орган работает в реальном времени: где кровоток усилен или нарушен, какие участки ткани более активны, а какие, наоборот, «молчат». Именно поэтому радиоизотопная диагностика стала ключевым инструментом раннего выявления опухолей, ишемии, воспалений и других функциональных расстройств.
Что такое лучевая терапия
Это один из старейших и при этом постоянно развивающихся методов лечения опухолей. Его история начинается в конце XIX века, когда сразу после открытия рентгеновских лучей врачи заметили: излучение может не только «просвечивать» ткани, но и подавлять рост новообразований. Затем в медицине появились радиоактивные элементы, в том числе радий, которые позволили создавать контактные методы лечения, когда источник излучения размещается прямо у опухоли.
Настоящий прорыв произошел в середине XX века. Инженеры разработали приборы, которые формируют управляемый поток излучения высокой энергии. Появились гамма-терапевтические аппараты, первые кобальтовые установки, и чуть позже — линейные ускорители электронов, которые направляли дозу лучей гораздо точнее, чем раньше, непосредственно в опухоль, уменьшая повреждение здоровых тканей.
Отечественная ядерная медицина зародилась в 1940-х годах, на начальном этапе советского атомного проекта, когда производство изотопов на ускорителях и реакторах стало налаживаться. В 1950-е годы Институт биофизики Минздрава СССР начал выпуск источников ионизирующего излучения для лучевой терапии и специальных медицинских приборов, таких как линейные ускорители электронов, и гамма-терапевтические установки, которые поставлялись в клиники страны и даже за рубеж.
К концу существования СССР в стране функционировало 650 отделений радионуклидной диагностики, 20 отделений терапии, ежегодно проводилось не менее 1,5 миллиона клинических исследований, выпускалось 140 видов радионуклидов и 38 радиофармацевтических препаратов.
Сегодня достижения советской школы продолжаются в рамках корпорации «Росатом», которая развивает линейку препаратов, совершенствует способы их применения, обучает врачей современным методикам ядерной медицины и внедряет эти технологии в клиниках по всей стране.

Как на практике проходит терапия с помощью направленного ионизирующего излучения? В общих чертах процесс выглядит так.
- Планирование. Пациент проходит КТ или МРТ, по которым врачи точно определяют расположение опухоли и составляют план облучения — сколько дозы нужно и под какими углами ее подать.
- Позиционирование. Перед процедурой пациента укладывают в строго фиксированное положение, чтобы каждый сеанс проходил одинаково точно.
- Облучение. Линейный ускоритель или другой аппарат посылает к опухоли пучок излучения. Он повреждает ДНК раковых клеток, мешая им делиться и приводя к их постепенной гибели.
- Курс лечения. Обычно терапия проводится небольшими дозами каждый день в течение нескольких недель, чтобы дать здоровым тканям время на восстановление.
Что такое радиофармпрепараты
Параллельно с лучевой терапией и диагностикой в медицине развивалось и другое направление — лечение с помощью радиоактивных препаратов.
Радиофармпрепараты — вещества, в которых радиоактивный изотоп соединен с молекулой-«навигатором», способной находить определенные клетки или органы. Они выпускаются в разных формах: таблеток, растворов для инъекций или капсул — в зависимости от того, куда нужно доставить изотоп.
Таким образом, радиоактивное вещество точно находит цель и начинает работать прямо там, где это необходимо.
Терапия с использованием радиоактивных элементов появилась в начале XX века и началась с радия: в 1901 году французские ученые применили его для лечения кожной формы туберкулеза, а через несколько лет американский изобретатель основоположник телефонии Александр Белл (1847-1922) предложил использовать радий против опухолей. В 1923 году в СССР радионуклид радий-224 начали применять для уменьшения болей в суставах.
В 1936 году американский врач Джон Лоуренс (1904-1991) применил радиоактивный фосфор для лечения лейкемии. А уже в 1941 году для пациента с заболеванием щитовидной железы впервые приготовили лечебный препарат на основе радиоактивного йода. Этот метод также применяется и сегодня. В 1951 году в США официально разрешили использовать йод-131 для терапии щитовидной железы, а в 1952 году Лоуренс и его коллеги испытали более точный метод воздействия на опухоль гипофиза с помощью узконаправленного потока альфа-частиц, заложивший основу высокоточных методов радиотерапии.
В СССР в 1946 году под руководством советского биофизика Г. М. Франка (1904-1976) была организована Радиационная лаборатория № 8. Спустя два года ее преобразовали в Институт биологической физики АМН СССР — будущий Федеральный медицинский биофизический центр имени А. И. Бурназяна. С самого начала институт стал главным научным центром страны по разработке радиофармпрепаратов.

В 1967 году начал свою работу завод «Медрадиопрепарат», специализировавшийся на производстве медицинских радиофармпрепаратов. И в 1970-е годы продукция завода использовалась более чем в 500 медицинских учреждениях СССР и других стран.
Как создают «лечебный атом»
Около 80 % медицинских изотопов (прим. ред.: разновидность атома одного химического элемента, отличающаяся массой ядра из-за разного числа нейтронов) получают прямо на атомных электростанциях — в реакторах. После того как топливо отрабатывает свой ресурс, в отходах остается множество радиоактивных элементов. Специалисты аккуратно «выделяют» их, очищают и превращают в лекарственные формы, готовые к применению в клиниках.
Оставшиеся 20 % изотопов производят на ускорителях частиц. Это почти как современная алхимия: частицы разгоняются до огромных энергий, направляются в специальную мишень, и на выходе получается нужный радиоактивный изотоп, который затем превращают в препарат.
Ключевые производственные площадки в России — Ленинградская и Смоленская АЭС, а также научные центры вроде «НИФХИ имени Л. Я. Карпова» в Обнинске.
После того как изотопы произведены и очищены, их превращают в радиофармпрепараты, готовые к использованию в медицине.
Какие именно изотопы применяют врачи?
- Йод-131, йод-125 — для терапии заболеваний щитовидной железы.
- Технеций-99m — для диагностики заболеваний сердца, костей, почек и других органов.
- Лютеций-177, Актиний-225, Самарий-153 — для целевой терапии опухолей и метастазов.

Когда применяются радиофармпрепараты
- Радионуклидная терапия — метод лечения рака, при котором радиофармпрепараты доставляют радиоактивный изотоп прямо к опухолевым клеткам. Излучение разрушает раковые клетки локально, минимально повреждая здоровые ткани.
- Бор-нейтронозахватная терапия (BNCT) — инновационный метод «сверхточного» лечения опухолей. Пациенту вводят соединение с бором, которое накапливается только в опухолевых клетках. Затем облучают нейтронным потоком: когда нейтроны сталкиваются с бором, высвобождаются высокоактивные частицы, уничтожающие только опухоль. Этот метод особенно эффективен при труднооперабельных и рецидивирующих опухолях, таких как глиобластомы, меланомы и опухоли головы и шеи.
- Радиофармпрепараты в терапевтической и функциональной медицине: эта область объединяет ревматологию, эндокринологию и кардиологию.
- Ревматология (радиосиновэктомия) — препарат вводится прямо в воспаленный сустав, локально разрушает пораженную ткань, уменьшает боль и отек, не повреждая здоровые структуры.
- Эндокринология — радиоактивный йод I-131 применяется при гипертиреозе и раке щитовидной железы; изотоп накапливается именно в клетках щитовидной железы, прицельно снижая их активность или уничтожая опухолевые участки.
- Кардиология — радионуклиды помогают оценить кровоток и жизнеспособность миокарда, выявить участки с недостаточным кровоснабжением и контролировать эффективность терапии.
- Паллиативная медицина — радиофармпрепараты доставляют излучение прямо к пораженным участкам, например, при метастазах в кости, облегчая боль и улучшая качество жизни пациентов при минимальном воздействии на остальной организм.
- Онкотерраностика — комбинированный подход, объединяющий диагностику и терапию. Один препарат сначала «подсвечивает» опухоль на ПЭТ/ОФЭКТ-сканере, а затем разрушает ее радиацией. Это позволяет врачам точно контролировать локализацию препарата, повысить эффективность лечения и минимизировать облучение здоровых тканей.

Перспективы и инновации в лечении «мирным атомом»
На недавнем заседании научного совета Российской академии наук «Науки о жизни» участники подчеркнули, что главная цель современной радионуклидной диагностики и терапии — сделать противораковое лечение максимально персонализированным. Одним из ключевых трендов сегодня является миниатюризация молекул, применяемых для адресной диагностики. Чем меньше молекула, тем выше контраст визуализации и тем быстрее врач получает диагностический результат. По словам экспертов, именно малые молекулы сейчас составляют основу большинства клинических испытаний в мире. Россия также активно движется в этом направлении. Так, по словам академика Сергея Деева, в Научно-исследовательском центре «Онкотераностика» в Томске уже разработаны шесть противораковых соединений, успешно прошедших первую фазу клинических испытаний. Одно из соединений — первая в России тераностическая пара радиофармпрепаратов на основе BQ-ПСМА (прим. ред.: простат-специфический мембранный антиген — особый протеин на поверхности клеток рака простаты) для диагностики и терапии рака предстательной железы. Параллельно исследуются альтернативные молекулярные мишени, например, рецептор гастрин-высвобождающего пептида (GRPR). Его можно представить как «ярлык» на поверхности раковых клеток: он есть почти во всех опухолевых клетках простаты, особенно на ранних стадиях, но почти отсутствует на доброкачественных, то есть неопасных, тканях. Благодаря этому открываются возможности для ранней и точной диагностики, а также для персонализированного выбора терапии.
Ученые Института реакторных материалов (АО «ИРМ», часть Научного дивизиона Росатома) в Заречном Свердловской области впервые в России освоили производство изотопа тербий-161. Этот изотоп перспективен для эффективного лечения злокачественных опухолей. Его терапевтическое действие достигается за счет излучения бета-частиц и электронов Оже (прим. ред.: они появляются не из самого ядра, а из атомной оболочки), которые разрушают раковые клетки. На основе тербия-161 планируется выпуск целого ряда новых радиофармпрепаратов следующего поколения.

Тестовая партия продукции была передана на испытания в Российский научный центр радиологии и хирургических технологий имени академика А. М. Гранова в Санкт-Петербурге. Центр специализируется на радиологии и разработке радиофармпрепаратов, а также проводит исследования в области онкологии и ядерной медицины.
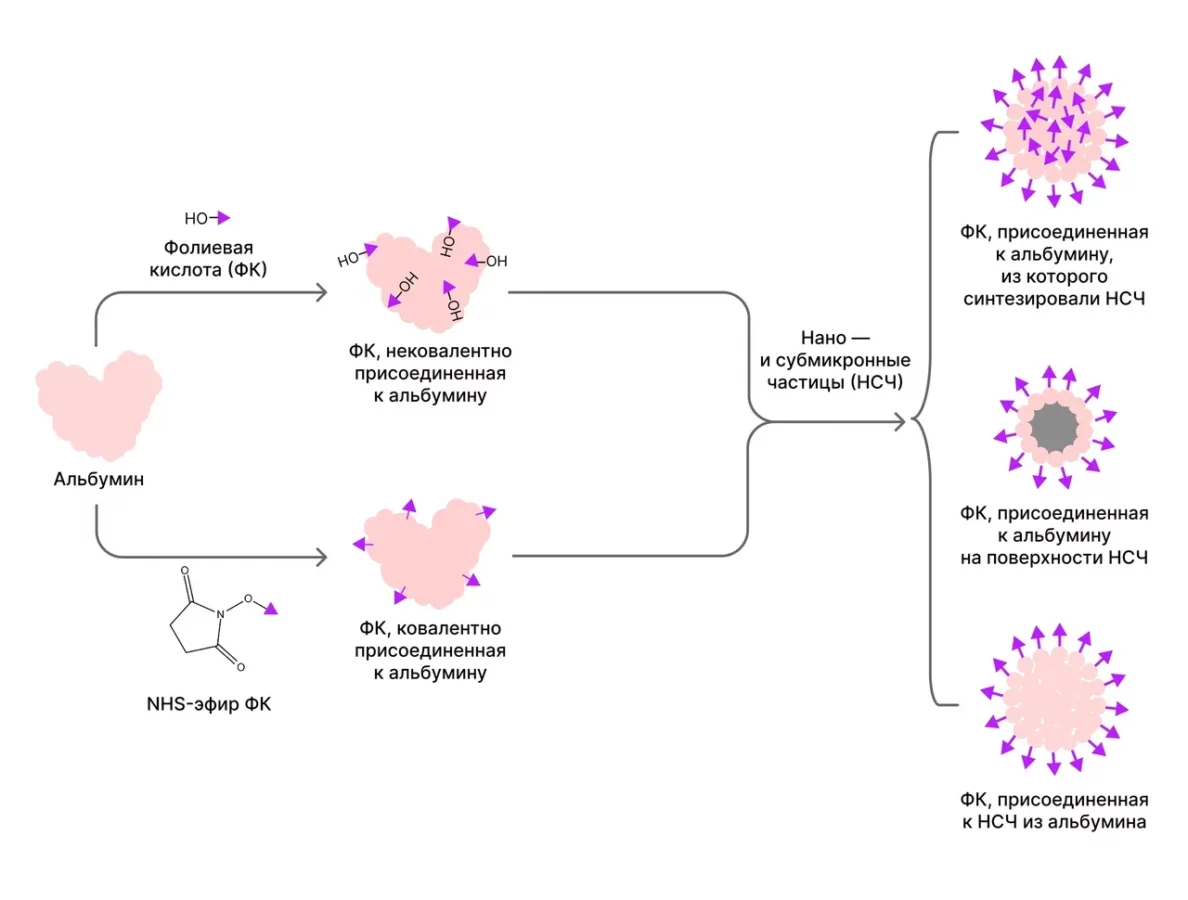
При этом радионуклидные технологии находят применение не только в онкологии. В Медицинском радиологическом научном центре им. А. Ф. Цыба успешно провели клинические исследования лечения радиофармпрепаратами синовита коленных суставов. Использовался отечественный препарат на основе микросфер альбумина, меченых радиоактивным изотопом рения-188 (Re-188). Такой подход показал отличные результаты — воспаление снизилось, боль уменьшилась, а подвижность суставов восстановилась. Таким образом подтвердив, что радионуклидные технологии эффективны не только против опухолей, но и при других заболеваниях.

Полученные результаты подтверждают высокий потенциал отечественной науки и приближают момент, когда инновационные радиофармпрепараты российского производства войдут в широкую клиническую практику.
****
Развитие технологий производства изотопов, создание новых радионуклидов, таких как тербий-161, и внедрение инновационных препаратов для онкологии, ревматологии и других областей демонстрируют огромный потенциал ядерной медицины. Сегодня радиофармпрепараты продолжают открывать новые горизонты диагностики и терапии, превращая идеи науки в реальные клинические решения и улучшая качество жизни пациентов. Они позволяют не только точно диагностировать различные заболевания, выявляя очаги поражения на ранних стадиях, но и прицельно воздействовать на патологические ткани, минимизируя вред для здоровых органов. Благодаря этому подходу лечение становится более эффективным, безопасным и персонализированным.
Автор текста Анастасия Будаева
Изображение на обложке: Радиофармпрепараты (участок производства генераторов технеция 99-m). Фото: Александр Ульяненко/Пресс-служба АО «Технологии здоровья»
В статье использованы изображения из Атом. Медиа