Фотосинтез является одним из важнейших процессов биосферы, в ходе которого происходит превращение энергии света в энергию химических связей. Одной из наиболее простых и стабильных систем для сбора и эффективной трансформации солнечной энергии обладают фотосинтезирующие бактерии. Основой их фотосинтетического аппарата являются так называемые светособирающие комплексы LH (от английского – light-harvesting).
Выяснение архитектуры этих сложноорганизованных молекул является ключом к пониманию деталей механизма улавливания и переноса ими солнечной энергии. В статье, опубликованной в журнале Structure, ученые ФИЦ Биотехнологии РАН, НИЦ «Курчатовский институт» и ФИЦ ПНЦБИ РАН (Пущино) детально проанализировали установленную ими трехмерную структуру комплекса LH2 из пурпурной серной бактерии Ectothiorhodospira haloalkaliphila, полученную методом криоэлектронной микроскопии с разрешением 1.7 Å – наивысшим для объектов этого класса.
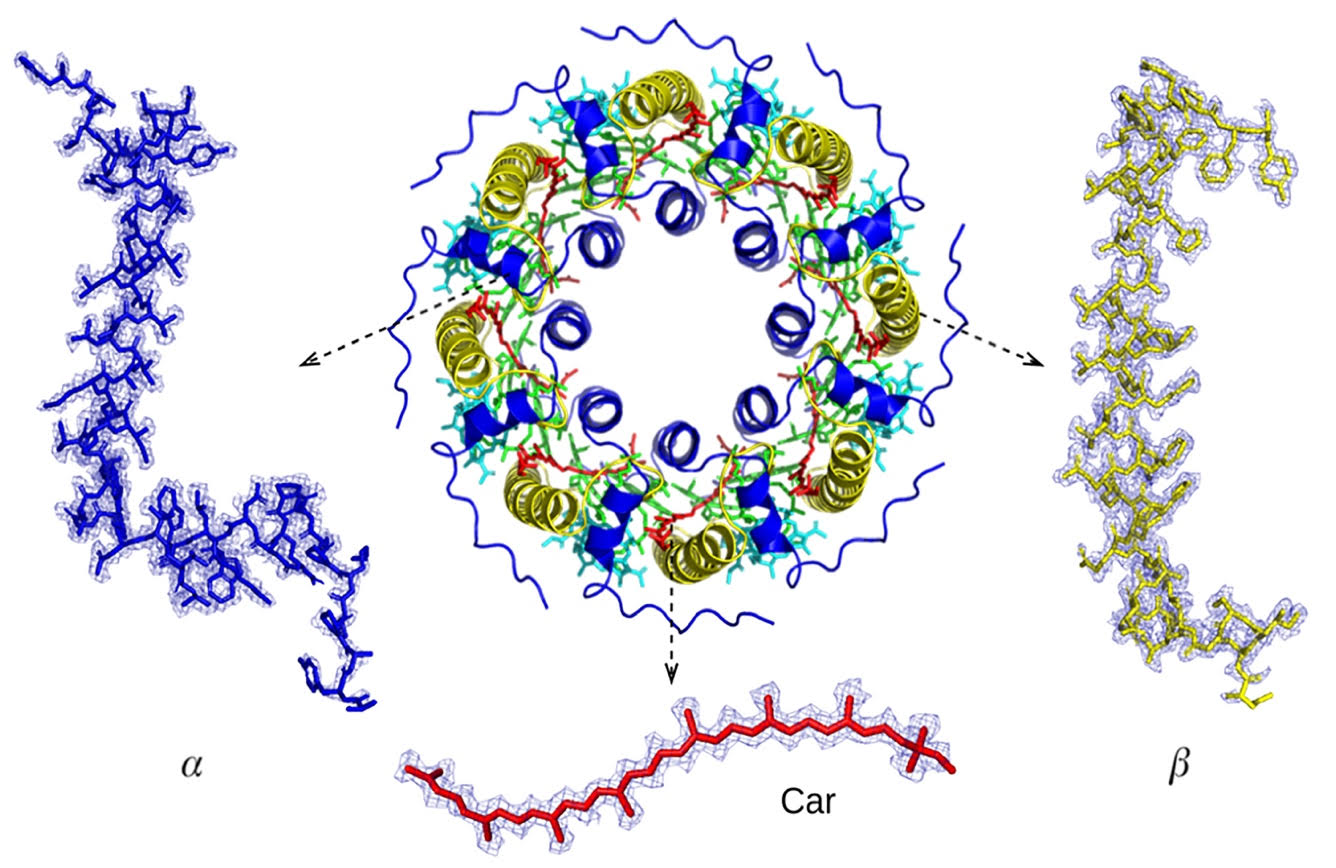
Светособирающие комплексы бактерий – это мембранные белки, устроенные по модульному принципу из одинаковых субъединиц, каждая из которых в свою очередь состоит из нескольких типов молекул - двух полипептидов (α и β), а также пигментов - бактериохлорофилла и каротиноидов. При этом в зависимости от вида бактерий и условий их роста количество субъединиц, состав полипептидов и тип каротиноидов в таких комплексах могут существенно различаться. Для серных пурпурных бактерий была известна лишь одна структура комплекса LH2 из Marichromatium purpuratum, установленная с высоким разрешением и представляющая собой гептамер (7 субъединиц), организованный в кольцо, каждая субъединица которого связывает две молекулы каротиноида. В работе же российских ученых, проводимой в рамках гранта РНФ № 23-74-00062, была реконструирована структура комплекса LH2 из другого представителя серных бактерий и показано, что она существенно отличается от установленной ранее.
«Первые структуры светособирающих комплексов были получены в середине 90-х годов прошлого века методом рентгеноструктурного анализа. Поскольку эти комплексы являются мембранными белками, то их кристаллизация представляет собой весьма сложный и непрогнозируемый процесс. С развитием метода просвечивающей криоэлектронной микроскопии, за которую в 2017 г. дали Нобелевскую премию по химии, подавляющее большинство структур мембранных белков получают этим методом, который мы также применили в своей работе. Нам удалось установить структуру комплекса LH2 с околоатомным разрешением, что позволило не только провести сравнительный анализ, но и однозначно определить полипептидный состав комплекса и предположить наиболее вероятный тип каротиноида, который он связывает», — рассказывает первый автор научной статьи Анна Бурцева, младший научный сотрудник лаборатории инженерной энзимологии ФИЦ Биотехнологии РАН.
Ученые выяснили, что бактерия Ect. haloalkaliphila имеет целый кластер генов, кодирующих полипептиды, формирующие LH2, что, по-видимому, отражает приспособляемость бактерии к изменяющимся окружающим условиям. Так, в расшифрованном геноме бактерии было обнаружено шесть пар генов, кодирующих α- и β-полипептиды. Благодаря высокому разрешению была установлена конкретная пара генов, формирующих исследуемый LH2 комплекс. Кроме того, высокое разрешение позволило определить наиболее вероятный тип каротиноида в комплексе, что также было подтверждено альтернативными методами. Проведенный анализ показал, что несмотря на схожий общий принцип организации комплекса, структура LH2 из Ect. haloalkaliphila существенно отличается от ранее известной структуры из серной бактерии Mch. purpuratum, в частности, тем,что каждая его субъединица содержит по одной молекуле каротиноида. Это привело, в частности, к существенно иной - восьми-субъединичной архитектуре комплекса из Ect. haloalkaliphila.
«Структура и взаимное расположение строительных блоков (полипептидов и пигментов) светособирающих комплексов определяют, в частности, спектральные свойства последних. Точное определение состава и координации составляющих комплекс молекул критично важно для детального изучения и корректного описания процессов передачи энергии. При этом большинство установленных структур светособирающих комплексов имеют средний уровень разрешения, препятствующий зачастую даже правильной идентификации аминокислотной последовательности полипептидов, что приводит к некорректному сопоставлению структур со спектральными данными. Нам удалось получить структуру с очень высоким уровнем детализации, что вкупе с проведенными дополнительными экспериментами сняло вопросы относительно архитектуры и точного состава компонентов LH2 комплекса», — объясняет один из руководителей исследования Константин Бойко, к.б.н., старший научный сотрудник лаборатории инженерной энзимологии ФИЦ Биотехнологии РАН.
Источник: ФИЦ Биотехнологии РАН