25.01.2023
Недостаточность мозгового кровообращения (ишемия) — одно из сосудистых
заболеваний головного мозга. Этот клинический диагноз официально относят к
подклассу цереброваскулярных болезней. По последним данным, более девяти
миллионов человек в мире страдают от таких патологий, а это почти 12%
смертности. Сосудистые болезни мозга в страшной статистике уступают только
заболеваниям сердца и онкологии. Симптомы ишемического инсульта проявляются
не сразу, что усложняет оперативную постановку диагноза. Над решением этой
проблемы работают и ученые. Долгое время моделирование подобных процессов
было возможно исключительно на лабораторных животных, но не все полученные
эффекты оказались применимы к человеку. Тогда ученые из Нейрокампуса
РНИМУ им. Н.И. Пирогова Минздрава России занялись исследованием
индуцированных плюрипотентных стволовых клеток (ИПСК) и выращиванием в
пробирке органоидов мозга. О том, как это происходит, каких результатов удалось
достичь и как научная работа поможет в терапии ишемии, нам рассказала Вероника
Усатова, научный сотрудник лаборатории нейротехнологий Института
фундаментальной неврологии Федерального центра мозга и нейротехнологий ФМБА
России.
Моделирование процессов и заболеваний нервной системы
Направление, связанное с исследованиями ИПСК, и в частности с созданием
органоидов мозга, возникло в Федеральном центре мозга и нейротехнологий три
года назад, при формировании в структуре учреждения Института фундаментальной
неврологии.
В науке до появления технологии получения ИПСК моделирование процессов и
заболеваний нервной системы человека было возможно только при использовании
лабораторных животных, эффекты и закономерности, полученные на которых, часто
не воспроизводились на человеке. Применение ИПСК человека позволило получать
не только видоспецифичный материал, но и сохранять геномные особенности
конкретных доноров.
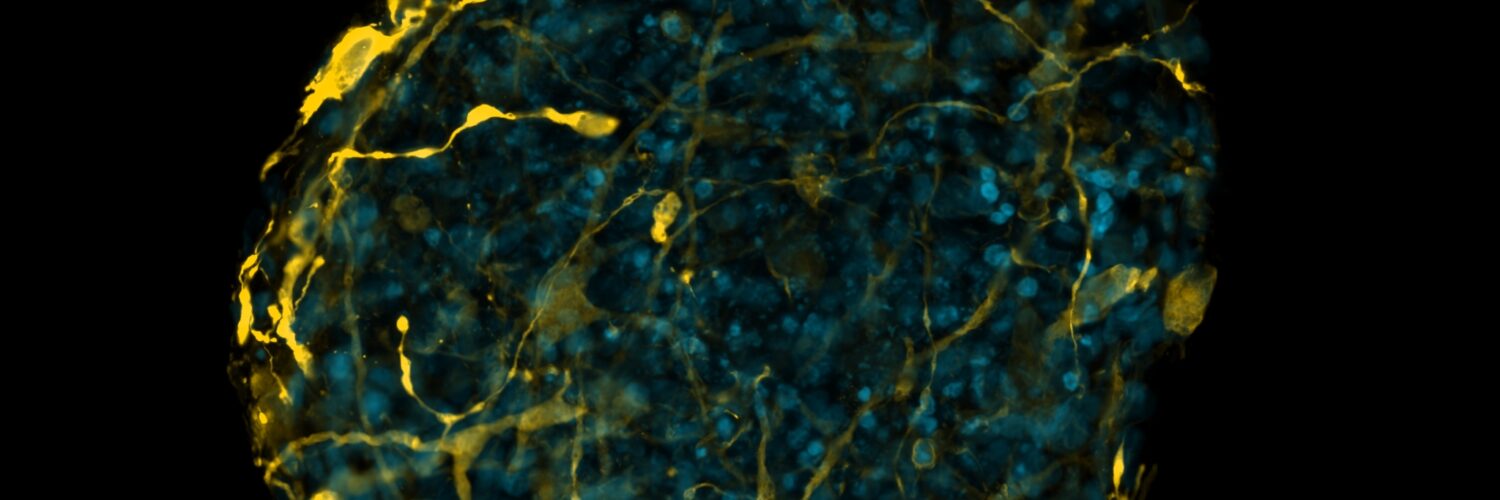
В органоидах мозга, представляющих собой трехмерные культуры, в которых
развиваются специфичные типы клеток, достигаются приближенные к
физиологически нормальным межклеточные взаимодействия и градиент
растворимых факторов. Это позволяет изучать на данных объектах особенности
развития человеческого мозга в норме и патологии, моделировать различные
неврологические расстройства человека, исследовать патогенетические механизмы
и определять эффективность лечения пациентов.
«Поп-ит» для создания зачатка нервной системы
Формирование сфероидов и их последующая дифференцировка (превращение) в
органоиды мозга могут осуществляться учеными различными способами в
зависимости от целей. Рассмотрим один из возможных вариантов.
На первом этапе получают эмбриоидные тела с потенциалом развития клеток в три
зародышевых листа: энтодерму, эктодерму и мезодерму. Это необходимо для
формирования прототипа внутренней клеточной массы на стадии перед
гаструляцией (как при естественном развитии эмбриона человека). Для этого ИПСК
помещают в специальные формочки из агарозы с большим количеством ячеек,
похожие на поп-ит. В них клетки оседают, не связываются со стенками формы, а
образуют только межклеточные контакты. Размер сферы зависит от количества
клеток и диаметра лунки.
На всех стадиях роста для сфер создаются необходимые условия культивирования
— они помещаются в инкубатор при температуре 37°C, поддерживается влажность
70% и уровень CO2 5%.
Через несколько дней в составе среды заменяются компоненты на те, которые
инициируют образование нейроэктодермы — зачатка нервной системы. Затем
происходит замена среды на подходящую для генерации нейральных
предшественников, из которых могут образовываться как нейроны, так и астроциты.
Завершающим этапом является стадия матурации (взросления). Здесь состав среды
подбирается таким образом, что процессы деления клеток замедляются, при этом
нейроны в составе органоида приобретают различные функции и образуют между
собой связи.
На разных стадиях дифференцировки ученые оценивают, из каких клеток состоит
органоид (методом иммуноцитохимии или проточной цитофлуорометрии), а также
функциональную зрелость нейронов (методом локальной фиксации потенциала
действия).
Совершенствование терапии при ишемии
Одно из направлений нашей команды в данной области исследований —
определение особенностей молекулярных механизмов ишемии и последующей
реперфузии мозга (повреждение ткани, вызванное возвращением к ней
кровоснабжения. — Прим. ред.) в острой фазе. Общепринятым мнением является
участие в патогенезе инсульта активных форм кислорода, которые при
неконтролируемой генерации приводят к окислительному стрессу.
Окислительный стресс в тканях мозга при инсульте неоднократно подтверждался, но
косвенными методами. В режиме реального времени на нейральных клетках
человека он до этого никогда не исследовался напрямую. Понимание данных
механизмов может выявить пути в терапии, направленной на коррекцию
метаболических и сигнальных процессов при ишемии.
Визуализация метаболических процессов
В рамках исследования мы получили органоиды мозга, в геном клеток которых
встроили белковые флуоресцентные биосенсоры, чтобы визуализировать
метаболические процессы. Данный подход позволяет через динамику
флуоресцентного сигнала отражать изменения изучаемого параметра, например
перемены концентрации соединения, с которым взаимодействует сенсорная часть
биосенсора. Таким образом, мы получили возможность в режиме реального времени
наблюдать, как меняется уровень пероксида водорода, рН и соотношения
НАД+/НАДН.
Далее, моделируя ограничение кровотока в мозге, мы создаем условия глюкозно-
кислородной депривации, то есть лишаем органоиды мозга кислорода и глюкозы в
жидкостном и воздушном окружении. В моменты гипоксии и последующей
реоксигенации с помощью флуоресцентной микроскопии в режиме реального
времени мы наблюдаем за изменениями флуоресценции клеток в составе органоида
мозга, чтобы выявить, как меняется уровень исследуемого нами метаболита или
параметра.
По последним данным наших экспериментов, мы не наблюдаем избыточной
продукции пероксида водорода в процессе гипоксии/реоксигенации. Из этого
следует, что указанный метаболит не является ключевым источником активных
форм кислорода в острой фазе ишемии-реперфузии. Такие выводы сопоставимы с
результатами, полученными нашими коллегами in vitro на первичных нейронах
гиппокампа мыши и in vivo на мозге крысы. Это может говорить о работоспособности
представленной модели и возможности ее использования для скрининга химических
веществ в рамках изучения данной патологии.




Нет комментариев